3月28日,美国食品药品监督管理局(food and drug administration,简称FDA)批准了OCREVUS™ (ocrelizumab)用于治疗复发-缓解型多发性硬化(RRMS)和原发进展型多发性硬化(PPMS),这是FDA批准的首个针对PPMS的药物。

OCREVUS™(ocrelizumab)是一种针对CD-20阳性B细胞的人源化单克隆抗体。这是一种静脉输注药物,患者每年需注射两次,每次600 mg,每年费用约65000美元。OCREVUS的上市许可申请(MAA)也已获得欧洲药品管理局(EMA)的批准,目前正在审核流程中。
在两项长达96周、共涉及1656名参与者的临床试验中,OCREVUS治疗复发-缓解型多发性硬化(RRMS)的疗效得到了验证。相比另一MS药物(干扰素β-1a),接受OCREVUS的患者复发率显著降低,并且残疾恶化程度相对减少。而由732名患者参与的PPMS研究中,进行了至少120周的试验,相比之下,接受OCREVUS的患者延长残疾恶化的时间更明显。
到目前为止,FDA已经批准了13种用于治疗复发性MS的药物(1993年首个),但是却没有一种可以治疗原发进展型多发性硬化(PPMS),OCREVUS是第一个。另外,OCREVUS是一种用于治疗成人患者复发或原发进行型多发性硬化的药物,对儿童是否安全、有效还未知。
FDA的Billy Dunn博士说:“多发性硬化对病人的生命有着深远的影响。这种新方法不仅为复发型MS患者提供了另一种治疗方案,并且首次为原发进行型MS患者提供了一种获得认可的治疗方案。”
在FDA和Genentech官网上发布的信息中也强调了 OCREVUS用药需注意的事项等。
什么是多发性硬化
------------------------
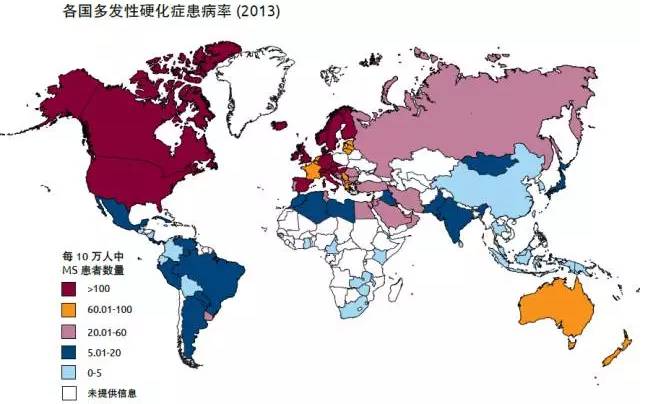
多发性硬化(MultipleSclerosis,MS)是一种罕见的中枢神经系统脱髓鞘疾病,青、中年多见,平均发病年龄一般在20至40岁,女性发病人数两倍于男性。临床特点是病灶播散广泛,病程中常有缓解复发的神经系统损害症状。该病的病变位于脑部或脊髓。
人体的神经细胞有许多树枝状的神经纤维,这些纤维就像错综复杂的电线一般。多发性硬化症就是因为在中枢神经系统中产生大小不一的块状髓鞘脱失而产生症状。
所谓“硬化”指的是这些髓鞘脱失的区域因为组织修复的过程中产生的瘢痕组织而变硬。这些硬块可能会有好几个,随着时间的进展,新的硬块也可能出现,所以称作“多发性”。
参考:
1. FDA Approves Genentech’s OCREVUS™(Ocrelizumab) For Relapsing and Primary Progressive Forms of Multiple Sclerosis
https://www.gene.com/media/press-releases/14657/2017-03-28/fda-approves-genentechs-ocrevus-ocrelizu
2. FDA approves new drug to treat multiplesclerosis
https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm549325.htm
3. Wikipedia, Ocrelizumab
https://en.wikipedia.org/wiki/Ocrelizumab
4. 5.25世界多发性硬化日:“我们不会被MS击垮”,中国罕见病
本文由中国罕见病网编译,转载请注明出处。

往期精彩 回顾
多发性硬化症(MS)每月一次注射药物Zinbryta欧盟上市在即
1. 愿以后的泪水都是喜极而泣—记被初步确诊全球不足百例的罕见病后
3. 食药监总局拟调整进口药品注册 中国患者能否“零时差”用上国外新药?
投稿邮箱:info@cord.org.cn
资讯 | 数据 | 孤儿药 | 会议 | 政策 | 患者组织
——罕见病行业门户信息平台——
www.hanjianbing.org
-----------------------------------------