一组老鼠出生60天后,正在逐一接受光信号刺激。随后,神经电生理专家监测到,这组老鼠有异常的电信号表达,说明它们可以看到东西。而这些特别的老鼠,出生的时候患有视网膜色素变性疾病——一种视野逐渐变小、视力逐渐变差,进而完全失明的高发疾病。

让这些老鼠看到光的,是广州市妇女儿童医疗中心眼科专家朱洁研究团队。朱洁研究发现,利用目前日臻成熟的基因编辑技术,能够在小鼠身上修复一部分视神经细胞,成功的使两种患有视网膜色素变性的小鼠恢复视力。相关的研究发表在国际知名学术期刊《细胞研究》上。“下一步,我们计划在更为大型的灵长类动物身上试验,完善动物实验后,这一技术有望走上临床,为视网膜色素变性患者提供恢复视力的有效治疗。”
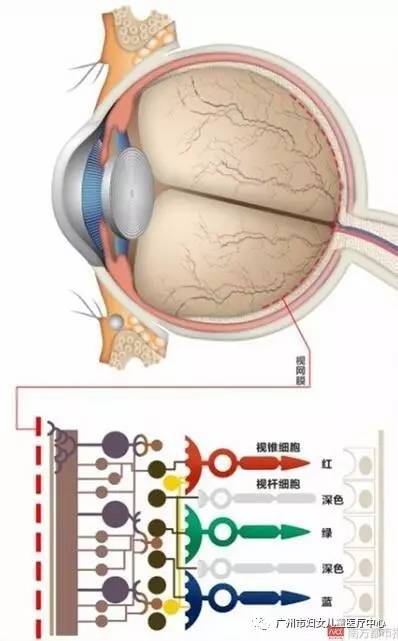
人类眼前好像
添加了一根细小的管子
视网膜色素变性,是一类遗传性的视网膜退行性疾病。患上这种疾病的患者,儿童或青少年期就会表现为夜盲,到了晚上就无法看清东西。随着病情的发展,患者的视野会越来越小,直到变成管状视野。这种疾病就像是在人类的眼前,添加了一个细小的管子,只能看见管子大小的世界,视野会变得非常微观和局限。随着病情的发展,这种管状视野会慢慢消失,或仅仅保留一点光感(能够感觉到光,但无法视物),或者干脆陷入一片漆黑。
截至目前,这一疾病并没有太多的治疗手段,营养视神经药物、维生素等治疗或许能够延缓病程,改变夜盲状态,但无法从根本上改变疾病的结果,患者的视野依然会不断的变小,视力仍然会逐渐丧失,直至失明。而且,由于患者的情况千差万别,有的遗传有视网膜色素变性的患者,在非常低龄时就开始发病,很快就进入到失明状态。
目前已知有60多种基因突变
可导致视网膜色素变性的发生
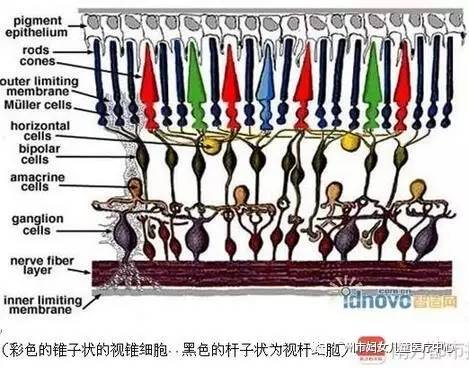
为了弄清楚疾病发病的原理,眼科专家们也曾深入对眼睛尤其是视网膜的结构、工作原理进行了深入的研究。之后,专家们发现,视网膜上分布着两种不同形状,分工也并不相同的感光细胞。一种呈杆状,被称为视杆细胞,大约1.2亿个,它主要分布在视网膜的四周,专责负责接收和处理夜间的弱光信号及余光信号;一种则呈锥状,被称为视锥细胞,约有600万个,它分布在视网膜中间,专责负责接受强光信号和红、蓝、绿三色光的接受和处理,并具备辨色功能。
“出现视网膜色素变性的患者,一开始主要是视杆细胞失活,使人们逐渐丧失对弱光、余光的接收处理能力,使视野越来越小。慢慢地,视锥细胞也被病情所牵连,出现紊乱,最终导致失明”,朱洁表示。在两种光感细胞中,根据统计,目前已知有60多种基因突变,可以导致视网膜色素变性的发生。虽然人类已经发现了疾病发生的原理,但这一导致严重视残疾的疾病,依然不可逆转。

废掉容易病变的视杆细胞
从源头阻断了疾病的发生
既然视杆细胞和视锥细胞都能接受处理光信号,而且视网膜色素变性这种致盲性疾病一开始攻击的就是接受余光、弱光的视杆细胞,视椎细胞的病变是受到牵连。那么有没有可能将视杆细胞转变为视锥细胞,保留患者的视觉功能,从而从源头阻断了疾病的发生。这样一来,患者感受弱光、余光的能力可能会受到影响,但感受强光、辨色的能力会得到保留,解决了患者最基本的视觉有无的问题,不会致盲。按照这一思路,眼科专家们决定开始通过各种手段去重新调控视网膜变性患者的视杆细胞生成,并将一部分视杆细胞分化成锥状的视锥细胞。
万幸的是,科学界对于感光细胞分化调控的不断认识,找到了调控感光细胞分化的关键基因Nrl和它下游的转录因子Nr2e3。抑制Nrl基因或其下游的转录因子Nr2e3的活性,就能抑制视杆细胞的生成,并将这一类原本应该变成视杆细胞的感光前体(一种多能干细胞,视杆细胞、视锥细胞两种感光细胞,都是由前体祖细胞分化而来),分化成锥体状的视锥细胞。

抑制关键基因后
试验老鼠依然保留有视力
基因编辑技术的发展,为精准的抑制Nrl基因和其下游转录因子Nr2e3成为可能。
研究团队首先决定,选取正常的、不患遗传性视网膜色素变性的老鼠来进行试验,以验证抑制了关键基因后,老鼠的视网膜上视杆细胞转化成视椎细胞的可能。“通过向正常老鼠的眼内注射基因编辑药剂,然后对小鼠的视网膜进行观察。
结果发现,不论是抑制了Nrl基因,还是抑制Nr2e3基因,试验小鼠的视网膜上,视锥细胞的数量会增加许多。”而随后,对这一批接受试验的老鼠检验视力,老鼠们都能感受到光刺激,依然保留有视力。朱洁表示,对正常老鼠眼内的试验性治疗,验证了眼科专家们最初的设想,医学界可以通过精准的基因编辑技术,将视杆细胞变成不容易病变的视椎细胞。
1
揭秘
基因治疗后,患病老鼠视力恢复到正常视力1/4-1/3
专家们尝试对明确患有视网膜色素变性疾病的小鼠进行类似的治疗。他们选取刚刚出生一周的小老鼠,这一阶段的小鼠感光前体细胞还未完全分化成为视椎细胞、视杆细胞。对其进行分组,一组在精准的基因编辑技术下,抑制住其Nrl基因,一组抑制住其Nr2e3基因点位,再有一组则完全不接受治疗,任其视网膜色素变性疾病自由发展。
经过若干天的观察,在小鼠长大到60天时,给老鼠们检查视力。对小鼠的视网膜进行检查后发现,运用基因编辑技术治疗后的两组老鼠,保留的感光细胞要比未治疗组的多得多,尤其是能够辨色、感受强光的视锥细胞,要比没有治疗的小鼠组多上数倍。“综合评估治疗组小鼠的情况后发现,这些小老鼠的视力能够达到正常视力的1/4-1/3。但远比没有治疗组近乎于零的视力要好得多”,朱洁表示。
2
释疑
这种基因编辑是否有伦理风险
朱洁表示,对小鼠进行视网膜色素变性治疗的方式,其实也是目前盛行的基因编辑技术的一种。编辑的方案,是使用目前认定对人类不致病的AAV病毒作为载体,将基因编辑工具CAS9(一种高效、精确敲除基因或敲入基因片段的工具,俗称DNA剪刀)和一段指导精确编辑定位的引导RNA携带到病变组织。这是一种非常精准的基因治疗方案。这一治疗方案并不直接修复突变基因位点,而是将易受突变影响的视杆细胞转变为更稳定的视锥细胞,从而扩大了治疗的适用范围。此外,由于该治疗方案并不涉及在生命初始的受精卵、胚胎阶段,对特定的基因进行修饰,只是局部的抑制基因表达,这一方案也没有人为、彻底修饰患病基因的伦理风险。
这种治疗手段何时能应用到人类
“目前我们正计划在猴类等大型灵长类动物身上开展类似的基因治疗研究。以观察跟人类基因组更为接近的猴子的治疗效果。如果通过了猴子的试验,我们也将计划逐步在人类患者身上开展相应的治疗研究。”朱洁表示,这一基因治疗思路没有直接针对突变的基因位点,而是通过细胞重编程将细胞分化为不受基因突变影响的细胞类型,从而保留组织功能。至于,什么时候治疗小鼠视网膜色素变性的技术能够应用到人类,目前仍没有时间表,希望在不远的将来,能够治疗视网膜色素变性患者,尽可能地保留或恢复视力,改善他们的生活。
(来源:南方都市报 记者:王道斌)