来源:药明康德
用基因工程对T淋巴细胞进行改造可以将它们转变为强有力的创新抗癌药物。25年以来,基于细胞工程和工艺制造的进步,T细胞疗法极大地改善了难治性癌症患者的疗效。其中最引人注目的案例之一就是CD19 CAR-T疗法。CAR-T疗法是在T细胞表面表达嵌合抗原受体 (chimeric antigen receptor, CAR),改变淋巴细胞的特异性和功能。靶向CD19的CAR在治疗B细胞癌变导致的血癌方面已经表现出良好的疗效。Kite Pharma和诺华公司的CD19 CAR-T细胞疗法都有望在今年获得FDA的批准上市。CD19 CAR-T治疗在一些白血病和淋巴瘤中的成功,有望将CAR-T细胞疗法应用到其他恶性肿瘤领域。一系列新型靶抗原和CAR设计正在开发当中,即将在血液和实体瘤中进行测试。此外,自体T细胞是目前基于细胞的癌症免疫治疗的重点,但同种异体细胞来源,包括干细胞衍生的“现成”T细胞,将在未来起到重要作用。最近,《自然》杂志对工程T细胞疗法的近况和发展方向进行了盘点。我们在本文中带来详细解读。
工程T细胞原理
T细胞在胸腺中发育时会获得称为T细胞受体(T cell receptor, TCR)的抗原受体。在生理条件下T细胞对抗原的识别由TCR-CD3复合体完成。TCR由α和β链组成,它们的结构决定了TCR的抗原特异性。CD3包括γ、δ、ε和ζ四种亚基,它的作用是启动T细胞激活程序。
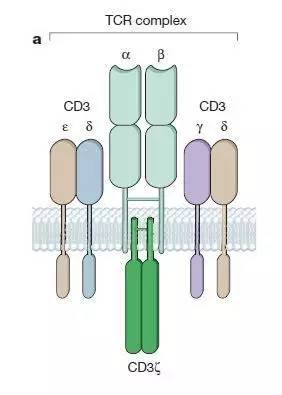
T细胞受体(TCR)结构
工程T细胞最自然的方式是利用基因工程在T细胞中表达针对特定抗原的TCR,它们与CD3形成复合体后,能够给予T细胞特定的抗原特异性。运用基因工程在T细胞中表达TCR可以产生大量在表型上与身体自然产生的T细胞相同的T细胞。对于那些自身无法产生足够免疫反应来对抗肿瘤或其它疾病的患者来说,这些抗癌或抗病毒的T细胞可以起到增强免疫反应的作用。目前这一策略的实施重点在于分离出具有最好特异性和亲和力的TCR,设计分子机制来防止TCR的交叉反应性(cross-reactivity),和减少α和β链之间发生的错配。TCR-T细胞疗法在治疗黑色素瘤 (melanoma) 和肉瘤 (sarcoma) 患者的小型临床试验中已经表现出显著的抗癌效果。
另外一种让T细胞识别新抗原的方法是通过设计针对抗原的人工受体。这种人工受体的细胞内片段通常需要CD3ζ链来保证该受体能够启动T细胞激活程序。第一代的CAR设计将CD3ζ链与能够识别抗原的抗体片段融合在一起,但是这种CAR设计在实验中不足以激发足够强大的免疫反应。目前的第二代CAR设计在人工受体中结合了T细胞共刺激 (co-stimulating) 信号受体。这种将T细胞激活片段(CD3z链) 和共刺激受体片段 (最常见的是CD28) 结合在同一CAR上的设计可以让T细胞不但能够识别特定抗原,而且可以分泌白介素-2 (interleukin-2) 并且在重复接触抗原后分裂增殖。二代CAR设计是目前CAR-T疗法的主流。
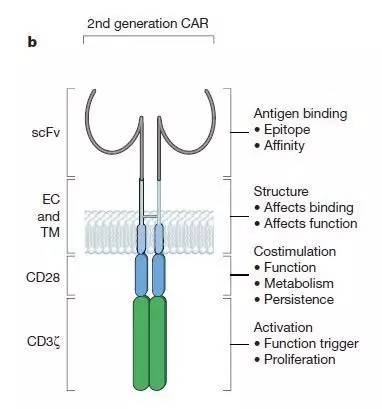
嵌合抗原受体(CAR)结构
二代CAR设计大多利用抗体单链可变片段(single chain variable fragments, scFv) 来识别抗原,目前已经有100多种特异性CARs,而且至少有8种共刺激信号受体片段被研究人员使用。其中被研究得最清楚的二代CAR设计方案是利用CD28和4-1BB共刺激域的CARs。这两类设计都已经在治疗复发性B细胞癌变的临床试验中取得了明显临床效果。基于CD-28的CARs能够促进活跃的T细胞增殖,但是T细胞持续性 (T cell persistence) 有限。而基于4-1BB的CARs 诱导效应T细胞(effector T cell) 的能力相对较低,但是支持更长的T细胞持续性。
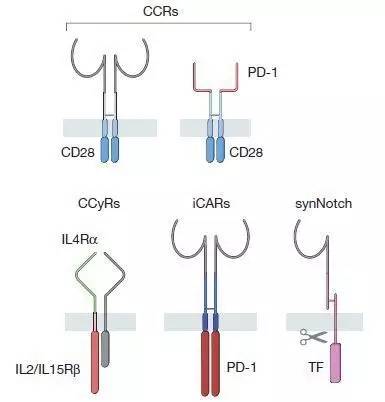
CAR家族合成受体成员
利用基因工程对T细胞的优化不只局限在表达不同的CAR或TCR来改变它们的抗原特异性上。与CARs一起表达在T细胞中的其它人工合成受体可以达到提高T细胞效力或安全性的作用。这些合成受体包括嵌合共刺激受体(chimeric co-stimulating receptors)、抗原特异性抑制受体(antigen-specific inhibitory receptors)和基于Notch的合成受体。这些合成受体给予研究人员更精准地调控T细胞激活的能力。
CAR-T细胞在临床应用上的典范:CD19 CAR-T疗法
CAR-T疗法在临床上的成功使用不但需要一个强有力的CAR,还需要一个合适的靶点。这个靶点最好在所有肿瘤细胞表面表达,但是至少不在重要的正常细胞中表达。CD19因为在大多白血病和淋巴瘤的肿瘤细胞表面表达而成为一个有潜力的靶点。靶向CD19虽然会造成B细胞发育不良,但是短期内患者可以耐受,而且清除B细胞可能阻止针对CAR的抗体的产生。
目前CD19 CAR-T疗法已经在治疗多种B细胞癌变的临床试验中获得了成功,其中包括急性淋巴性白血病(acute lymphoblastic leukemia, ALL)、慢性淋巴性白血病(chronic lymphocytic leukemia, CLL) 和弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma)。可喜的是虽然这些CAR-T疗法在CAR设计、转基因载体以及生产工序上有所不同,但是它们都获得了非常高的完全缓解率(complete response rate),对ALL的效果尤其出色。
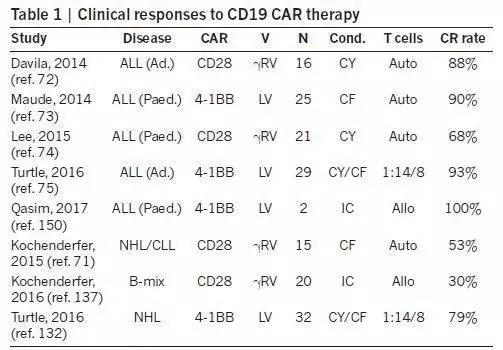
CD19 CAR-T疗法的临床试验反应率
值得注意的是同样的CARs在治疗ALL时获得的完全缓解率要高于CLL和淋巴瘤。目前关于T细胞在体内分布的临床数据还很少,但是已有数据显示决定CAR-T细胞的疗效的原因更可能是肿瘤微环境中的抑制分子,而不是T细胞运输方面的障碍。
推广CAR-T疗法应用范围需要解决的问题
CAR-T细胞疗法与免疫检查点抑制剂 (immune checkpoint inhibitors) 是如今给癌症免疫疗法带来革命性变化的两类疗法。免疫检查点抑制剂在治疗携带高度体细胞突变的肿瘤患者时的疗效最佳,而患者的肿瘤如果突变率不高,则对免疫检查点抑制剂的反应不佳。值得一提的是CAR-T疗法疗效显著的ALL是一种突变率不高的癌症。这意味着CAR-T疗法可能对那些突变率不高的癌症和免疫检查点抑制剂无效的癌症尤其重要。
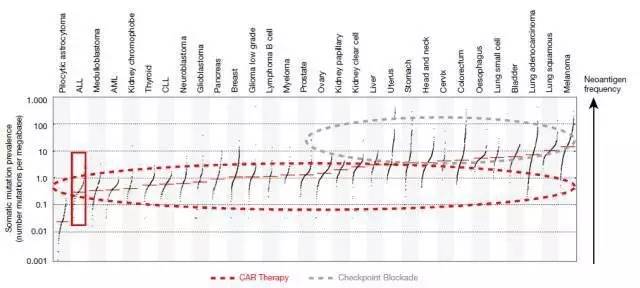
CAR-T疗法(红色虚线框)和免疫检查点抑制剂(灰色虚线框)应用的癌症类型
虽然CAR-T疗法理论上可以适用于所有癌症并且可以与其它疗法联合使用,但是将CAR-T疗法推广到更多癌症种类中需要以下多个领域的进展:
1. 发现工程T细胞的新靶点
在CD19 CAR-T疗法取得成功后,在治疗血癌方面有两个新靶点最近接受了临床试验的检验。它们分别是CD22和BCMA。CD22是一种在癌变B细胞中表达的B细胞抑制受体。CD22 CAR-T疗法在治疗ALL儿童患者中表现出可喜的疗效,这些患者的肿瘤已经经过CD19 CAR-T疗法或blinatumomab治疗并且复发。BCMA是表达在骨髓瘤 (myeloma) 细胞、正常浆细胞和部分B细胞中的TNF受体家族中的一员。BCMA CAR-T细胞在治疗12名骨髓瘤患者的临床试验中获得两例显著反应。
在治疗实体瘤方面,目前发现的新靶点还存在有不同的缺陷。ROR1、间皮素(mesothelin) 或前列腺特异性膜抗原(prostate-specific membrane antigen, PSMA) 都在部分健康组织中表达。虽然它们在健康组织中表达量很低,但是因此而造成的毒副作用仍然是不能忽视的问题。EGFRvIII是一种在胶质母细胞瘤(glioblastoma)中表达的EGFR拼接变体。它提供了更严格的肿瘤特异性,但是由于在肿瘤中表达水平不一限制了它完全消灭肿瘤的潜力。
基于治疗窗口(therapeutic window)和组合抗原识别(combinatorial antigen recognition)的靶向策略有可能帮助弥补这些缺陷。治疗窗口策略通过调节CAR的表达量或亲和力使它们能够区分出抗原表达水平的高低,从而在杀伤表达高水平抗原的肿瘤细胞的同时放过表达低水平抗原的健康细胞。组合抗原识别策略利用分裂信号受体(split-signaling receptor)、次序作用受体、抑制受体等其它受体与CAR的组合让T细胞的激活依赖于多种抗原靶点,从而降低T细胞的脱靶效应。
2. 克服肿瘤微环境的限制
肿瘤的微环境不利于T细胞正常发挥功能,因为这个微环境里缺氧、酸化、缺乏营养成份(例如葡萄糖、谷氨酰胺和L-精氨酸),并且充斥着坏死细胞和一系列免疫抑制分子(例如PD-L1, IL-10, TGFβ和吲哚胺-2-3双加氧酶)。因此,需要追加步骤来帮助工程T细胞克服微环境中的障碍。这些步骤包括使用联合疗法或者设计出能够对抗免疫抑制的更有效的T细胞 。
干扰免疫抑制细胞或通路的小分子,例如IDO抑制剂、来那度胺(lenalidomide)和腺苷拮抗剂(adenosine antagonist),很可能与工程T细胞达成协同作用。BTK抑制剂ibrutinib在临床前模型中显示出可以改善CAR-T细胞功能。免疫检查点阻断也可能帮助维持T细胞功能和持续性。有多种手段可以用来干扰免疫检查点蛋白的功能,其中包括阻断抗体,显性负性受体 (dominant-negative receptor) 和靶向基因破坏(targeted gene disruption)。后两种手段可以依靠对T细胞的基因工程来完成,从而避免了添加新试剂和增加毒性的风险。
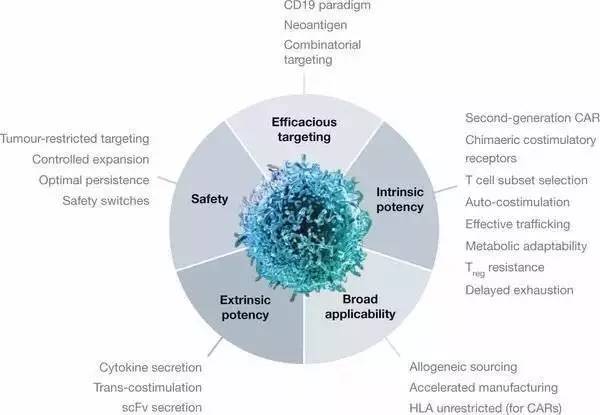
T细胞疗法设计的目的和策略
有些帮助工程T细胞克服肿瘤微环境的方法明年将进入临床试验。这些方法包括让T细胞在表达CAR的同时分泌诸如IL-12或 γc细胞因子或阻断抑制配体的分子。另外一种方法让T细胞持续表达共刺激配体来增强T细胞功能。例如表达4-1BB配体不但可以增强T细胞的固有持续性,而且可以为周围的肿瘤浸润T细胞提供靶向的共刺激。
3. 选择哪种T细胞进行基因工程改造
工程T细胞的抗癌能力依赖于它们迁移到肿瘤附近,增殖并且杀伤肿瘤细胞的能力。因此,除了通过基因工程给予T细胞对肿瘤抗原的特异性,增强其安全性和有效性以外,T细胞本身的特性也会对疗效有影响。对T细胞的进一步分析发现T细胞包括初始T细胞(naive T cell, TN),T记忆干细胞(memory stem T cell, TSCM),中央记忆T细胞(central memory T cell, TCM),效应记忆T细胞(effector memory T cell, TEM),组织驻留记忆T细胞(tissue resident memory T cell, TRM) 和效应T细胞(effector T cell, TE) 等T细胞亚型。T细胞的分化过程为从TN逐步分化成TSCM 和TCM,这些细胞可以自我增殖,并且进一步分化成生存时间较短的TEM和TE细胞。这一分化途径意味着选择分化程度较低的TN, TSCM或TCM作为基因工程的原材料可能产生疗效更高的工程T细胞。
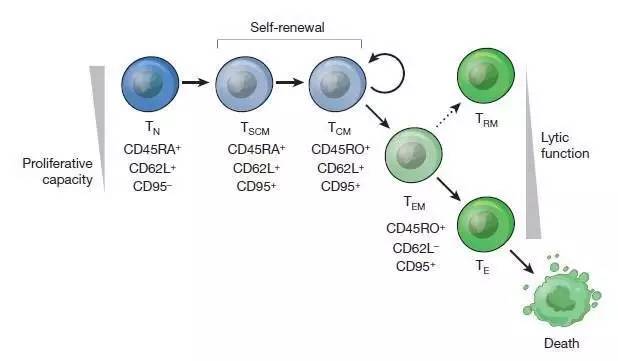
工程化T细胞来源
临床试验结果表明,选择特定T细胞亚型生成CD19 CAR-T细胞,不但可以以较少的细胞量达成显著的抗癌效果,而且注入的CAR-T细胞在体内的细胞扩增程度也比较一致。进一步改进选择T细胞亚型的方法和保留分化程度较低的T细胞亚型的培养方式将是未来临床研究的方向。
4. 使用同种异体T细胞的策略
目前为止所有成功的TCR和CAR-T疗法使用的都是自体细胞。这一选择的原因是为了防止注入的T细胞攻击宿主或者宿主排斥T细胞疗法。但是使用自体细胞不可避免地带来生产流程上的困难和不同患者之间的疗效差异性。使用同种异体T细胞的挑战在于如何避免或减少移植物抗宿主病(graft versus host disease, GVHD)。免疫抑制药物虽然可以减少GVHD的症状,但是并不适用于工程T细胞疗法,因为T细胞的抗癌作用需要不受免疫系统阻碍。
目前有三种防止GVHD的策略:第一种方法移植改造过的造血干细胞或T细胞前体而不是成熟的T细胞,这可以使注入的T细胞建立起对宿主的免疫耐受。但是这种方法需要患者具有正常的胸腺功能。第二种方法是选择那些造成GVHD风险较小的T细胞进行改造,例如病毒特异性T细胞(virus specific T cell, VST)。第三种增加同种异体细胞安全性的方法是去除这些细胞中的TCR。这可以通过破坏TCR的α或β链来完成。但是这三种手段只能防止CAR-T细胞不攻击宿主的健康组织,它们没有解决宿主的免疫系统排斥同种异体细胞的问题,因此在临床应用方面的效果有限。
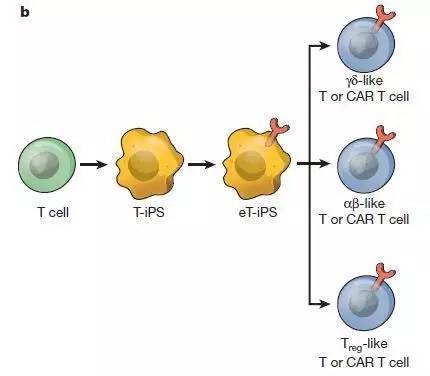
多能干细胞来源的T细胞
另外一种产生CAR-T细胞的方法是通过分化多能干细胞 (pluripotent stem cell)产生T细胞。干细胞重编程具有可以无限制地产生用于医疗的T细胞的潜力,而且这些细胞可以接受更多基因工程改造来改善分化出的T细胞的医疗潜力。
T细胞生产工艺方面的改进
用基因工程改造T细胞从转基因载体开始,反转录病毒载体(retroviral vectors)目前仍然是TCR或CAR-T细胞中最常使用的载体。由于反转录病毒载体的整合方式是半随机的,这会导致携带的基因表达水平参次不齐。另外一种表达CAR的方法是通过mRNA转染,这种方法导致的基因表达只能持续几天。使用靶向核酸内切酶 (targeted nucleases) 介导的基因编辑技术可以将表达CAR的基因定向地整合到T细胞的基因组中。在TCR基因座上表达CAR可能对T细胞的功能有更多益处。因此,靶向核酸内切酶介导的基因敲除或插入是T细胞基因工程的发展方向。
T细胞的生产过程是一个需要综合疗效、安全性、可重复性、追踪性,以及需要满足监管和经济需求的复杂科学项目。目前临床T细胞的生产过程需要达到FDA的良好生产规范(good manufacturing practice, GMP) 标准。生产最佳的T细胞亚型不但可以提高安全性、疗效以及可重复性,而且可以降低完成治疗所需的T细胞剂量,从而降低生产规模和成本。
目前用于筛选特定T细胞亚型的GMP抗体不但数目有限,而且非常昂贵。正在发展的新科技,包括用声波捕捉、分离和富集T细胞亚型,微流控(microfluidics)技术和相变水凝胶基质(phase-change hydrogel substrate) 技术,可能有助于解决这一问题。这些技术平台可以与其它体外富集T细胞亚型的技术相结合,包括使用诸如GSK-3β抑制剂的小分子药物或者IL-7、IL-15、或IL-21等细胞因子处理T细胞。T细胞疗法的兴起促进了创新生产平台的产生和生产标准的建立。假以时日,这些改变将对所有细胞疗法带来裨益。
总结
25年以来,基于细胞工程和工艺制造的进步,基因增强的T细胞极大地改善了难治性癌症患者的疗效。其中最引人注目的例子是CD19 CAR-T治疗。
然而,人类尚未完全掌握这种全新的治疗方式,T细胞疗法仍有很大的优化和改进空间。尽管在没有替代治疗方案的B细胞恶性肿瘤患者中可以获得高度的完全缓解率,但一半的患者往往会发生复发,这通常是由于抗原损失变体。尽管治疗相关毒性方面取得了进展,但严重的细胞因子释放综合征和神经毒性的机制了解甚少,还没有有效的预防措施。 因此,需要进一步改善B细胞恶性肿瘤和其他癌症的CAR-T疗法。
一系列新型靶抗原和CAR设计将在血液和实体瘤中进行测试。CD19 CAR-T治疗在一些白血病和淋巴瘤中的成功是解决其他血液恶性肿瘤的好兆头。然而,需要确定实体肿瘤中的合适靶标(无论是新抗原,癌-睾丸抗原还是非突变的肿瘤相关抗原),定义用于过继转移的最佳T细胞类型,以及解决免疫抑制性肿瘤微环境。 此外,需要新的设备和工艺来降低制造成本。自体T细胞是目前基于细胞的癌症免疫治疗的重点,但同种异体细胞来源,可能包括干细胞衍生的“现成”T细胞,在未来可能起重要作用。
虽然最近的突破都聚焦在肿瘤学领域,但可以预期,T细胞疗法将在其他领域获得更大的发展。 CD19 CAR-T治疗的成功以及治疗性T细胞工程技术水平的提高,使得细胞疗法应用到免疫疗法和再生药物等领域成为可能。
参考资料:
Therapeutic T cell engineering
END
会议推荐
尊敬的畅言客户,您好。您所使用的网站评论功能已广告作弊被限制使用,如有疑问,请咨询客服电话400-780-9680。