作为非霍奇金淋巴瘤最常见类型,弥漫大 B 细胞淋巴瘤(DLBCL)受到广泛关注。经常有患者提问:用什么方案治疗、有效率多少?为什么有些人治疗效果好、有些人不好,如何预测?化疗结束并且达到完全缓解,今后还会复发吗?一旦复发该如何治疗?
ASH2016 和近期 JCO、Lancet 发表论文,就这些问题提出新的观点和建议,今天让我们一起来学习一下原发于淋巴结 DLBCL 的治疗、预后、复发和挽救性治疗的相关问题。
DLBCL的初治治疗
近 20 年来,利妥昔单抗(CD20 单抗)的免疫治疗联合传统的 CHOP 方案(R-CHOP)可以显著改善患者预后。
2002 年 NEJM 报道,利妥昔单抗联合化疗可以明显提升治疗有效率,随访 2 年,完全缓解率(CR)从 63% 提升到 76%;2005 年 JCO 报道,利妥昔单抗的加入预测可以使患者 2 年的无进展生存(PFS)从 51% 提升到 69%,2 年的总生存(OS)从 52% 提升到 78%。从而奠定了 R-CHOP 方案作为大部分 DLBCL 患者一线治疗方案的地位。
由于 DLBCL 疾病本身的异质性,约 30%~50% 患者出现难治或复发,其中 15%~25% 的患者在治疗期间即不可控制,20%~30% 的患者在达到完全缓解后复发。

双打击淋巴瘤或者双蛋白表型淋巴瘤的治疗:值得探索
双打击(double-hit)淋巴瘤或者双蛋白表型(double-protein-expression)淋巴瘤常常初治就表现为难治。针对这部分患者,有中心建议采用更强的初始治疗方案,推荐 DA-R-EPOCH 方案、R-ACVBP 方案,但随后的临床研究发现这些方案与传统的 R-CHOP 比较 CR 率无明显差别,PFS 和 OS 延长有限。除此之外,尚有加大 CD20 单抗剂量来提升疗效,但总体而言,这些方案疗效提升空间不大,值得进一步探索新的靶向药物联合的治疗之路。
从发病机制分析,有理由首先选择 MYC、BCL2 抑制剂与化疗的联合,这些药物目前均处于临床试验阶段,部分药物发现虽然有疗效,但是同时伴随严重的血液系统不良事件。
小结
初治治疗总体而言需要结合危险度和年龄的分层治疗;
R-CHOP或类似方案是大部分DLBCL患者的一线治疗方案;
50%~60%的患者通过R-CHOP治疗可以达到临床治愈;
双打击或双表型淋巴瘤常常初始就表现为难治,R-CHOP方案治疗是不够的,年轻患者可以尝试高强度化疗。
DLBCL 患者的预后
1. 与 DLBCL 预后相关的参数
除了传统的 IPI 和 NCCN-IPI 预后评分系统,近年来,还有许多研究分析各种影响 DLBCL 预后的参数。
临床相关参数有:中间 PET-CT 评估阳性、骨髓早期侵犯、低白蛋白血症、瘤体>5 cm、外周血淋巴细胞比例升高,诊断时的贫血和高 CRP 等——这些都可能与难治相关。
检测相关参数有:CD30 阳性,Ki-67%>80%,CD59 高表达,CD20 低表达,血清高表达 sIL-2R、sCD27、IL-18,高β2 微球蛋白,循环肿瘤 DNA 检测,HLA-G 多态性以及多种基因突变和原癌蛋白高表达等等。但这些参数需要进一步扩大样本量分析并明确。
2. CR 后的复发率
最近来自丹麦奥尔堡大学一组大样本的临床数据,随访了 1621 例 DLBCL 初始治疗后达到完全缓解(CR)或CRu的患者,初始化疗均为一线R-CHOP 或者 R-CHOP 样方案,中位随访时间 85 个月,以配对的普通人群作为对照。分析比较了初始治疗后长期缓解患者与配对普通人群的生存差异。从临床角度分析,患者达到完全缓解后复发的概率有 2 个独立因素:缓解的时间和年龄。
统计方式采用了末次治疗后生存期(pOS),末次治疗后无事件生存期(pEFS)和标准化死亡率(SMR),即 DLBCL 患者的死亡风险。分别评估了患者在 pEFS 不同时段(6 月,24 月,36 月,48 月和 60 月)的 SMR。
结果发现:DLBCL 患者 5 年 pOS 明显低于对照组(78% 比 87%)。基线(治疗结束)SMR 为 1.75,随后 SMR 明显降低,pEFS24 降低至 1.27,pEFS48 为 1.32。进一步年龄分层分析,年龄 <50 岁的患者在 pEFS24 时预期生存与对照组没有明显统计学差别(5 年 pOS,99% 比 99%; SMR 为 1.11)。在所有 222 例年龄<50 岁的患者中,只有 8 例患者(4%)在随访期间死亡。相比之下,在年龄 ≥ 50 岁患者组,即使达到 pEFS60 仍然提示死亡风险增加(SMR,1.36; P = 0.001)。
1621 例患者在治疗后的前 10 年与对照组相比,剩余寿命降低平均为 1.07 月/年。达到 pEFS24,pEFS36 和 pEFS48 的患者中,剩余寿命降低分别为 0.31 月/年,0.29 月/年和 0.29 月/年。
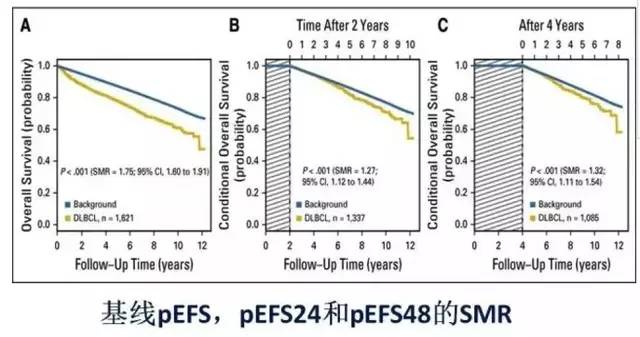
总体 5 年疾病复发率为 18%,在 pEFS24 组则降低至 8%,在 pEFS48 组别,5 年疾病复发率在<50 岁,50~60 岁和 ≥ 60 岁年龄组分别为 4%、7% 和 10%。
死亡风险主要来源于早期和晚期复发,占了所有死亡的 40%,其次是并发二次肿瘤和心血管疾病。随着观察时间的延长,淋巴瘤复发概率下降而其它并发症风险增高,超过 pEFS48 个月后,患者患其它癌症的死亡风险与淋巴瘤复发的风险相似。
总共有 83 例患者在随访中患其它肿瘤,其中死亡 13 例(16%),分别为 5 例骨髓增生异常综合征和 8 例急性骨髓性白血病。
小结
初治患者达到 CR 或 CRu 后,随着缓解时间的延长,复发风险降低;
年龄是独立预后因素,<50 岁患者预后好,没有性别差异;
初始治疗后疾病控制良好并无事件生存期超过 24 个月后,患者生存期接近普通对照人群;
随着患者生存期的延长,需要关注后续二次肿瘤的发生和心血管不良事件。
复发 DLBCL 的挽救性治疗
目前,还没有标准的治疗复发 DLBCL 方案。
一个理想的挽救性治疗策略是:诱导治疗期达到 >60% 的 CR,可以顺利进行自体造血干细胞移植,随后进行维持治疗在这种策略下, ~60% 晚期复发患者生存期可以超过 5 年。然而,一旦患者不适合进行自体造血干细胞移植,治疗会非常棘手。
传统的挽救性化疗方案 R-ICE、R-DHAP、R-ESHAP、R-GEM-P 方案仍然被推荐。
目前正在尝试新靶向药物的联合化疗,如 HDAC 抑制剂 Valproic acid 和 Belinostat,Bromodomain 和 extraterminal 的抑制剂 OTX015,VEGFR 及其激酶抑制剂 Vatalanib 和 Sunitinib, BCL-2 抑制剂,Ibrutinib 以及针对 CD30、CD19 和 CD40 的各种单抗等等。这些新药联合化疗的总体有效率约为 50%,CR 率约为 30%,但是从目前获得临床数据分析,这些药物并不优于传统联合化疗方案。
不适合移植的患者可以采用维持治疗来预防疾病再次进展和复发,可能有效的维持治疗药物有下列 6 种:rituximab、enzastaurin、lenalidomide(来那度胺)、everolimus、radioimmunotherapy 和 PD-1 抗体。部分药物的临床试验结果并未显示患者获益,其中,lenalidomide 和 PD-1 抗体最有希望,小样本数据显示可以提升患者有效率并延长生存。
CAR-T 治疗同样引人瞩目,研究最多的是抗 CD19 的 CAR-T 疗法。由美国国立卫生研究院(NIH)引导的 CAR-T 治疗 9 例复发难治的 DLBCL,其中 4 例获得 CR。在 ASH2016 会议上,MD Anderson 癌症中心公布了 ZUMA-1 的 2 期 CAR-T 免疫疗法结果,DLBCL 组的总缓解率在 3 个月末为 39%,同时观察到伴随严重不良事件包括神经毒性(25%)和细胞因子风暴(14%),临床试验中有 1 位患者死于免疫系统的过度应激。
小结
大剂量化疗+自体造血干细胞移植是一种措施;
不适合移植的患者挽救性治疗后建议维持治疗,推荐药物来那度胺和 PD-1 抗体;
新药的不断研发和临床应用,期望可以筛选高效低毒的联合用药方案;
CAR-T 免疫疗法持续获得关注,在国内外大型的血液中心均在谨慎又积极开展相关临床试验。
本文作者:浙江大学医学院附属二院血液科 梁赟
编辑:汪小鱼 | 题图来源:视觉中国
参考文献:
1. Jakobsen et al. JCO 2017. January. Published online.
2. JAmes O Armitage et al. Lancet 2017, January. published online.
3. Kochenderfer JN, et al. JCO 2015;33(6):540.
4. Diffuse large B-cell lymphoma: R-CHOP failure-what to do? ASH2016.
5. Checkpoint inhibition and cellular immunotherapy in lymphoma. ASH2016.