来源:孙锋医生 作者:吴国豪
胃肠肿瘤患者蛋白质-热卡缺乏性营养不良发生率较高,再加上术前和术后的禁食、手术创伤应激以及术后可能发生的并发症,进一步加重了患者营养不良。营养不良及机体消耗不仅损害机体组织、器官的生理功能,而且增加手术危险性、术后并发症及病死率。
合理的围术期营养支持治疗可以改善患者的营养状况,降低机体组织消耗,提高手术耐受性,有助于患者安全度过手术创伤所致的应激反应,降低围术期并发症发生率,保证术后发生并发症患者的营养需求,维持机体有效的代谢和器官、组织功能。本研究主要介绍胃肠肿瘤患者围术期营养支持治疗的作用、适应证、时机及实施方案。
一、胃肠肿瘤患者的代谢改变
胃肠肿瘤患者普遍存在营养不良。据最近文献报道,40%~80%的胃肠道肿瘤患者存在营养不良,约1/3的患者存在厌食、进行性体质量下降、贫血或低蛋白血症等恶病质征象。胃肠道手术患者营养不良的原因有很多,除疾病本身原因外,还与围术期禁食、手术创伤应激等密切相关。临床上,胃肠道手术患者常处于应激性饥饿状态。这类患者由于术前准备或术后一段时间内无法正常进食,机体被迫处于饥饿或半饥饿状态。应激则是每例手术患者在术后必然经历的阶段,是手术创伤所致。
由此可见,胃肠道手术患者围术期不仅存在饥饿状态,而且还存在对创伤、败血症和重症疾病的代谢反应。饥饿状态下机体会发生一系列代谢改变,以维持组织基本代谢需求和器官的功能,而创伤应激则可引起机体分解代谢增加,导致机体代谢紊乱及机体自身组织消耗增加。这些代谢变化均可导致或加重已存在的营养不良,从而影响患者的临床结局。
1、恶性肿瘤患者营养不良的原因
恶性肿瘤患者营养不良有肿瘤本身的原因和进行抗肿瘤治疗的相关因素。因此,胃肠道恶性肿瘤患者营养不良及恶病质的发生与肿瘤负荷、疾病进程、细胞类型以及抗肿瘤治疗等有关。
(1)厌食:食欲丧失是恶性肿瘤患者常见症状,也是引起恶性肿瘤患者营养不良的主要因素之一。恶性肿瘤患者的厌食主要是食物摄取中枢和相关的外周信号通路紊乱所致。肿瘤生长过程中产生的代谢产物作用于下丘脑饮食中枢,使之发生厌食、疼痛、发热等症状。肿瘤生长增加了血浆及大脑中色氨酸浓度,引起下丘脑腹内侧核5-羟色胺能神经元活性增强,在厌食的发生过程中起到重要作用。
此外,IL-1、IL-6、TNF-α、Ghrelin、瘦素Leptin、肥胖相关因子PYY及胰高血糖素样肽-1等在厌食的发生中同样发挥重要的作用。对于胃肠恶性肿瘤患者,肿瘤生长导致胃肠道机械性梗阻、胃排空延迟、消化吸收障碍、体液异常丢失等均可导致进食减少、厌食。胃肠恶性肿瘤患者经常伴有味觉和嗅觉异常,心理因素、压抑、焦虑和肿瘤疼痛等也可影响食欲及进食习惯。肿瘤的治疗,特别是化疗、放疗与手术治疗引起的食欲不良和组织消耗均会加重患者营养不良和恶病质的发生。
(2)物质代谢改变:恶性肿瘤细胞代谢改变主要是肿瘤相关代谢程序重排所致,并且此过程与肿瘤恶性程度、侵犯和转移能力相关。恶性肿瘤细胞代谢改变的发生机制包括两方面,即肿瘤释放某些因子以及机体对肿瘤的免疫与炎症反应。前者主要是脂肪或蛋白质动员因子,后者主要是各种细胞因子和急性相反应蛋白作用的结果。
以葡萄糖酵解为主要的能量获取方式被认为是恶性肿瘤细胞碳水化合物代谢的重要特征。恶性肿瘤组织通过糖酵解通路产生大量乳酸,产生的乳酸通过糖异生作用再生成葡萄糖,这增加了宿主的能量消耗。此外,恶性肿瘤患者对葡萄糖的耐受力较差,存在高胰高血糖素血症,导致葡萄糖更新加速。
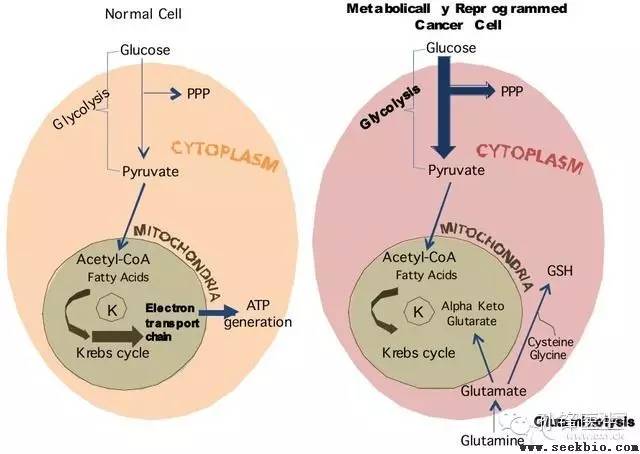
恶性肿瘤患者蛋白质代谢改变主要表现为骨骼肌萎缩、低蛋白血症、瘦体组织下降、器官蛋白消耗、蛋白质合成减少和分解增加、蛋白转化率升高、血浆氨基酸谱异常以及机体呈现负氮平衡。细胞因子TNF-α、IL-1、IL-6、IFN-γ以及蛋白降解诱导因子等在恶性肿瘤患者蛋白质代谢中起着十分重要的作用。
恶性肿瘤患者的脂肪代谢改变主要表现为内源性脂肪水解和脂肪酸氧化增强,TG转化率增加,外源性TG水解减弱,血浆游离脂肪酸浓度升高。脂肪分解和脂肪酸氧化增加导致机体脂肪储存下降,体质量下降,脂肪消耗成为肿瘤恶病质的重要特征之一。
恶性肿瘤患者能量代谢改变也是导致营养不良的可能原因。恶性肿瘤患者总体上处于高代谢状态,机体细胞内水含量减少、细胞外水含量增高、身体脂肪及瘦体组织水含量明显下降。能量消耗增高明显的肿瘤患者,其体质量下降的发生率、下降程度以及机体组成的改变也较其他恶性肿瘤患者明显,而且更容易发生恶病质。事实上,恶性肿瘤患者葡萄糖和蛋白质转化增加,脂肪分解作用增强,糖原合成加速等耗能过程是恶性肿瘤患者机体代谢率增高的病理基础,从能量平衡的角度来说,恶性肿瘤患者的营养不良更大的可能是由于能量消耗增高所致。
2、胃肠道手术围术期的代谢改变
胃肠道手术患者围术期常处于应激性饥饿状态,营养底物摄入不足或吸收不良、机体消耗增加以及创伤炎症反应均加重患者已存在的氮丢失和机体组织消耗,从而影响患者的临床结局。
(1)饥饿时的代谢变化:围术期由于术前准备的需要或手术创伤的原因,在较长一段时间内患者无法正常进食,使得机体处于饥饿状态。饥饿的本质是外源性能量底物和必需营养物质缺乏,在无外源性营养物质供应的情况下,为维持最基本的生命活动和器官功能,机体利用自身的组织供能。饥饿早期,机体首先利用机体储存的糖原,但饥饿24h后肝糖原即耗尽。随后,机体主要通过身体脂肪、肌肉蛋白分解释放游离脂肪酸及氨基酸来提供糖异生原料,依赖糖异生作用产生葡萄糖供能。随着饥饿的持续,机体适应性改变之一是脂肪动员增加,成为主要的能源物质,从而减少蛋白质的消耗。
长时间饥饿可引起机体明显的代谢及生理变化,如内分泌系统紊乱、免疫功能降低、消化能力下降等。这一切变化的目的是调动身体潜能使机体处于一种高度应激状态,有利于机体能够更好地抵御饥饿。长时间饥饿可导致机体组成的显著变化:蛋白质不可避免地被分解,使组织、器官质量减轻,功能下降。因此,临床医师应该尽可能避免使患者长时间处于禁食状态,术后尽早恢复进食,均可减少由于长时间饥饿引起的代谢改变以及由此可能对患者造成的损害。
(2)创伤应激的代谢变化:手术不可避免地造成机体应激性损害,机体内稳态失衡。如果术后出现感染等并发症,机体的应激状况持续存在,机体组织不断被消耗,此时如得不到及时纠正和营养物质补充,会出现不同程度的蛋白质消耗,影响器官的结构和功能,最终将导致MODS,影响患者预后。
手术创伤应激状态下机体代谢特征是高血糖症,能量消耗增高及蛋白质分解增强。术后高血糖是糖异生增加和外周组织摄取利用葡萄糖减少所致,应激性高血糖增加了手术患者的病死率。
手术创伤后机体蛋白质代谢改变是蛋白质分解增加、负氮平衡,其程度和持续时间与应激程度、创伤前营养状况、患者年龄及应激后营养摄入有关,并在很大程度上受体内激素反应水平的制约。择期手术和小的创伤导致蛋白质合成率下降而分解率正常。严重创伤和感染则表现为蛋白质分解率明显增加,导致蛋白质净的分解代谢。
身体脂肪分解增加是手术创伤后机体代谢改变的又一特征,创伤应激时脂肪分解成为体内主要能量来源,且不受外源性葡萄糖摄入的抑制。应激时脂肪动员和分解加强,血中游离脂肪酸和酮体有不同程度的增加,以提供大多数组织细胞能量。
(3)炎症反应:手术创伤所致的炎症反应可引起机体细胞和组织各种各样的损伤性变化,机体产生IL-1、IL-6和TNF等细胞因子,这些炎性介质不仅可引起机体全身应激反应,能量消耗增加,而且可以诱导身体脂肪、肌肉蛋白等组织的降解,从而造成机体自身组织消耗和营养不良。
二、胃肠道手术患者营养状况的评价
营养不良对围术期患者的不良影响主要表现为创伤愈合缓慢、免疫功能低下、骨骼肌功能下降、心肺功能不全,从而使手术并发症发生率增加、住院时间延长、再入院率和病死率增加。目前的证据表明:营养不良的胃肠道手术患者术后并发症的发生率明显高于营养状况良好患者,并且住院时间、费用及病死率均增加。
营养不良的发生率与所采用的营养评价方法和标准有关。目前,临床上有多种营养评价方法,但各种营养评价方法及手段均存在一定的局限性,尚没有一个或一组评价方法能对营养不良做出灵敏度高、特异度均高的诊断。不同的营养评价指标得出的营养不良程度存在一定差异。对于住院患者,理想的评价方法应当能够预测机体在缺少营养支持治疗的情况下患者发病率和病死率是否增加,能够预测营养相关性并发症的发生,从而提示预后。
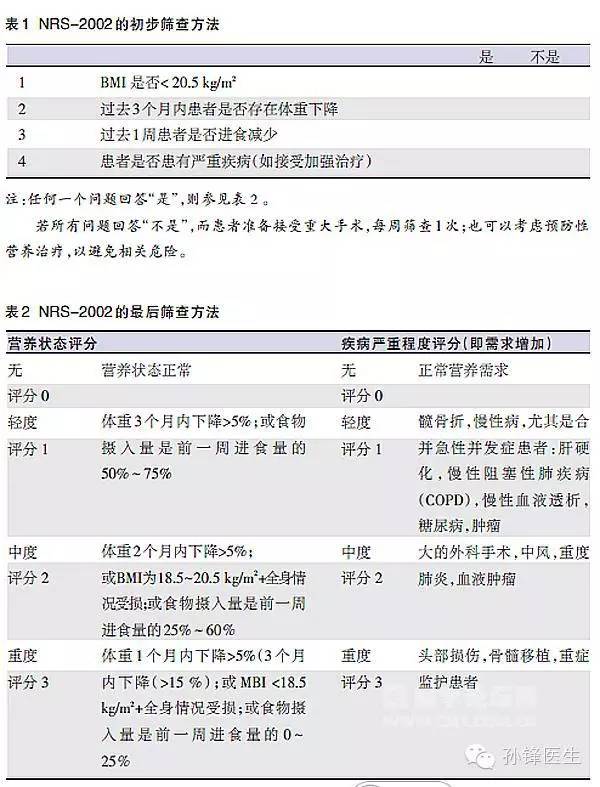
营养风险筛查2002(NRS2002)评分被国际上多个营养学会推荐作为住院患者营养风险筛查首选工具!其优点为具有循证医学证据基础,应用相对简单,被广大临床医师所接受,如下图。其他营养评价方法如BMI、血清Alb水平、主观全面评定、微型营养评估等在住院患者中亦有应用。
三、胃肠道手术患者围术期营养支持
临床上,任何治疗成功与否取决于患者是否从该治疗中获益。大量的临床证据表明:围术期合理的营养支持治疗可改善胃肠道手术患者的预后。
1、围术期营养支持治疗的指征
许多国际营养学会指南推荐:对于营养状况良好或者无营养风险的择期手术患者一般可以耐受手术创伤,不需营养支持治疗。对于营养不良程度较轻、手术创伤较小、术后早期就能够通过消化道进食的患者,同样无需进行围术期营养支持治疗。相反,重度营养不良患者,中等程度营养不良需要行大手术的患者,尤其是重大、复杂手术后严重应激状态的危重患者,通常不能耐受长时间营养缺乏,围术期营养支持治疗则可以使他们临床获益。
围术期患者手术前营养支持治疗指征有:
(1)重度营养不良患者;
(2)中等程度营养不良而需要接受创伤大、复杂手术的患者。
术前营养支持治疗应持续7~10d,更短时间的营养支持治疗则难以达到预期效果,上述患者即使因为术前营养支持治疗而推迟手术,患者依旧会获益。
围术期手术后营养支持治疗指征有:
(1)术前接受营养支持治疗的患者,术后继续营养支持治疗;
(2)严重营养不良由于各种原因术前未进行营养支持治疗的患者;
(3)术后估计超过5d不能进食的患者;
(4)术后出现严重并发症,需要长时间禁食,或者存在代谢需要明显增加的患者。
2、围术期营养支持治疗的方式
围术期营养支持治疗方式包括口营养补充(ONS)、肠内营养和肠外营养,3种营养支持治疗方式各自有其适应证和优缺点。一般说来,消化道功能正常或具有部分消化道功能患者,应优先使用ONS或肠内营养;肠内营养不足时,可用肠外营养补充。营养需要量较高或希望在短时间内改善患者营养状况时,则应选用肠外营养支持治疗。
ONS主要应用于能够进食但又无法摄入足够食物和水分以满足机体需要的患者。如果患者吞咽功能正常、具有一定消化吸收能力,均可以考虑通过ONS给予一定量宏量营养素和微量营养素。ONS的目标是对于营养不良或存在营养风险又无法通过进食摄入足够营养物质的患者,通过ONS改善患者食物和液体的整体摄入状况从而最终改善患者的临床结局。
肠内营养是一种简便、安全、有效的营养支持治疗方法。与肠外营养比较,肠内营养具有比较符合生理状态,能维持肠道结构和功能的完整,费用低,使用和监护简便,并发症较少,以及在摄入相同热卡和氮量情况下节氮作用更明显等诸多优点。因此,对于具有围术期营养支持治疗指征的患者,只要胃肠道功能正常或具有部分胃肠道功能,应首选肠内营养支持治疗。
凡是需要进行围术期营养支持治疗但又不能或不宜接受肠内营养支持治疗的患者均为肠外营养支持治疗的适应证。此外,临床上许多患者虽然能够接受肠内营养支持治疗,但由于疾病等原因,通过肠内营养支持治疗无法满足机体对能量及蛋白质的目标需要量,需要补充或联合应用肠外营养支持治疗。
3、围术期营养支持治疗的方案
肠内营养支持治疗可通过口服、经胃、经幽门后、经空肠等途径供给。具体供给途径的选择则取决于疾病情况、喂养时间长短、患者的精神状态及胃肠道功能等。临床上应根据具体情况进行选择,正确选择供给途径可避免或减少可能出现的并发症。
大手术后患者可从手术应激后24~48h内开始行肠内营养支持治疗。创伤后早期肠内营养有助于维持肠道功能、改善营养状况、促进伤口愈合、减少并发症和缩短住院时间。肠内营养支持治疗开始时采用低浓度、低剂量、低速度,随后再逐渐增加营养液浓度、滴注速度以及投给剂量:
■ 一般第1天用1/4总需要量,营养液浓度可稀释一倍;
■ 如患者能耐受,第2天可增加至1/2总需要量;
■第3、4天增加至全量。
肠内营养液开始输注时的速率一般为25~50ml/h,以后每12~24h增加25ml/h,最大速率为125~150ml/h。输入体内的肠内营养液温度应保持在37℃左右,温度过低易引起胃肠道并发症。
肠外营养支持治疗的营养底物包括水、碳水化合物、氨基酸、脂肪、电解质、维生素和微量元素,临床上必须根据患者实际需要、代谢情况准确地给予。
提供合适的热量和营养物质是营养支持治疗成功与否的关键。目前普遍认为20~25kcal/(kg·d)热量可满足大多数外科手术患者每日能量目标量。
■ 葡萄糖是肠外营养支持治疗中主要的供能物质,每日葡萄糖供给量应<250~300g为宜,输入速度应 <3~4mg/(kg·min),以避免葡萄糖摄入过量所致的代谢不良反应,不足的能量可由脂肪乳剂供给。
■ 葡萄糖与脂肪乳剂在非蛋白热量中的比例为70%∶50%∶30%∶50%,具体根据患者疾病状态进行调节。
■ 氨基酸是肠外营养支持治疗的氮源物质,可提供机体合成蛋白质所需的底物。对于大多数手术患者,目前推荐应用平衡型氨基酸溶液,供氮量为0.15~0.20g/(kg·d)。
临床上配制和使用肠外营养液时推荐采用全合一营养混合液,也可采用标准化、工业生产的肠外营养制剂,有两腔袋或三腔袋形式,各个腔中装有标准配方的各种营养成分,需要时可根据患者实际情况添加维生素、微量元素和其他所需的特殊成分,是临床上围术期营养支持治疗十分便捷的肠外营养制剂,应用日趋广泛。
4、免疫增强型营养制剂的作用
近年来,随着药理营养素的出现和作用机制的明确,在标准营养配方基础上添加某些具有特殊作用的营养素,利用其药理学作用达到治疗和调节机体代谢与免疫功能的目的,即药理营养或免疫营养概念。
营养支持治疗也由传统的单纯提供能量和营养底物,维持机体氮平衡、组织器官结构与功能,拓展到通过提供某些特殊营养素来调控应激状态下机体代谢过程、炎性介质的产生和释放,刺激免疫细胞,增强免疫应答能力,维持肠黏膜屏障功能,保护机体重要器官功能,从而改善患者的临床结局。因此,免疫增强型营养制剂的应用使临床营养理念得以拓展和提升,从传统的“营养支持”变为“营养支持治疗”,深化了营养支持治疗的作用,提高了营养支持治疗的效果。
最近的荟萃分析结果显示:免疫增强的肠外或肠内营养支持治疗对接受大手术的患者有益,可减少术后并发症并缩短住院时间,其作用明显优于标准的肠外或肠内营养,值得在胃肠肿瘤患者围术期中推荐使用。
四、结语
围术期营养支持治疗是营养支持治疗领域中一个重要的组成部分,数十年来,尽管营养支持治疗的理论和技术得到快速发展,但外科患者营养不良的发生率仍居高不下,其中以老年、消化道疾病及恶性肿瘤尤为明显。营养不良导致瘦体组织消耗和负氮平衡,增加术后并发症的发生率和病死率。
总之,围术期合理、有效地提供营养支持治疗可改善患者的营养状况,提高机体免疫功能,降低感染性并发症发生率,缩短住院时间和降低病死率!
欢迎您加入我们的微信群:请加管理员微信linchuangkuakao,请务必标注您的专业、学历、职称!