
这是美业观察的第409期内容;新朋友请点标题下蓝字或搜索微信号mygc360关注。
上游系列
在医美行业的话语体系里,谈及医美器械及药物时,“FDA”和“CFDA”是两个高频关键词。
就像消费者会通过一定的“评价认证平台”去识别和判断机构,上游厂商在向医美机构推介自己的产品时,也会重磅地强调所拥有的这两个“背书”,作为品质、安全及合规性的识别码。
一方面,随着科技美容市场的爆发,亟需增强上游产品对B端和C端的透明度,使其的产品选择安全有效;另方面,部分大型医美机构向资本市场的进军,也要求其在医械等的合规性上做出行业表率。
“盾牌”也好,“标尺”也好,美国的FDA和中国的CFDA,无疑需要被当下这个行业的B和C更深认知。
FDA及CFDA的职责和意义是什么?业内人士如何看待两者异同?一个产品从申请认证到面向市场,需要一个怎样的流程?消费者如何关注并参与进来?本文将围绕这些话题展开。
文 /《美业观察》杜颖 发自北京
“美国人健康守护神”
▷美国作为全球医美消费最大市场,总部在不同国家的医美器械商,都对美国FDA的认证重视极高。而更显著的原因是FDA的专业水准所带来的权威及美誉。
▷FDA减缩自Food and Drug Administration,即食品药品监督管理局,是下设于美国卫生与公众服务部的一个机构。这个机构由专员办公室和4个监督该机构核心功能的理事会组成,包括:医疗产品和烟草,食品和兽医,全球监管业务和政策,以及运营。
▷而在职责范围上,FDA表述有5个方面:
·保护公众健康,确保食品是安全、健康、妥善标识的;确保药品、兽药、疫苗以及其他使用的生物制剂和医疗器械是安全和有效的;
·保护公众免受电子产品辐射;
·保证化妆品和膳食补充剂是安全的,并妥善标识;
·规范烟草制品;
·通过加快产品创新,促进公众健康。
▷可以看出,FDA的监管范围较为宽广,涉及关系公众健康的几乎所有产品。而如药物、医械等需要FDA认证的产品,在到达公众前,都需要遵循经历既定的流程以确保其安全和有效。
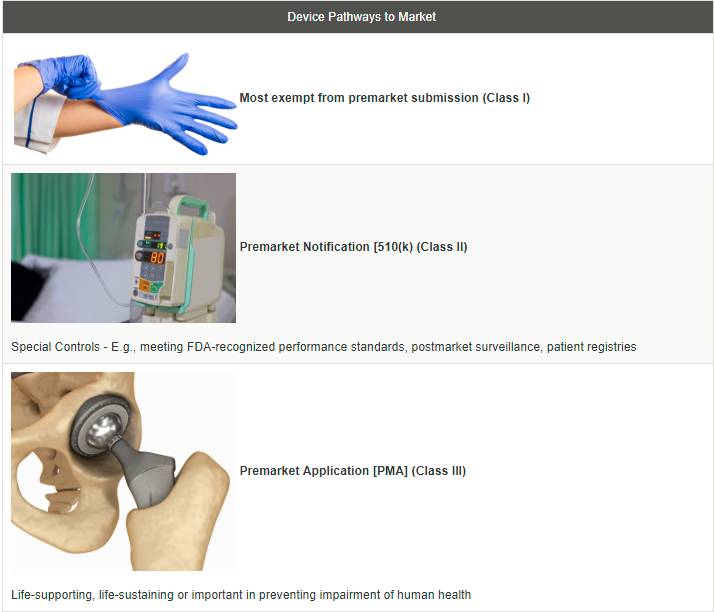
FDA分类的1、2、3类器械
▷拿医疗器械来说,FDA根据其风险性分为3类:
▷1类器械采取“一般控制”,这类设备如氧气面罩或外科手术工具等,带给消费者风险最小,对它们的要求包括良好生产规范、向FDA报告不良事件等。大多数免于上市前提交登记。2类器械相较1类给消费者带来更高风险,所以除上述外,还对它们有信息标识要求,特定的强制性能标准和测试要求。并于上市后对其监控,做患者登记。
▷3类设备则通常用于支持或维持生命,植入体内,或有潜在的不合理的疾病或伤害风险,需要在上市前经过批准。为了通过FDA审批,生产商必须证明其器械是安全有效的。而医美器械一般都属于3类的范畴。
▷FDA官方资料显示,申请认证的药物和医械的开发过程须经5个步骤,分别是:
1 研发:新药或器械的研发都从实验室开始;
2 临床前研究:药物和器械经过动物测试来回应关于安全性的基本问题;
3 临床研究:药物和器械经过临床测试,以确保其安全有效;
4 FDA审查:FDA审查小组彻底检查与药物或器械相关的所有提交数据,并作出批准或不批准的决定。
5 上市后安全检测:一旦产品供公众使用,FDA就会监控所有药物和器械的安全性。
后续监控+市场教育

FDA的“患者网络通讯”
▷值得一提的是FDA对产品上市后的持续监控——“虽然上市前临床试验提供了有关设备安全性和有效性的重要信息,但一旦设备投入市场,新安全问题就有可能出现。”
▷这样的后续监控通过几个方面来确保。首先是FDA对美国医械商制造设施的例行检查,以确保其遵循良好的制造规范,并对不符合者予以关闭;
▷另一方面是“问题报告”机制,FDA有几个通路以供制造商、卫生专业人士及消费者反馈设备相关问题:MedWatch——FDA的不良事件报告项目,是报告医疗产品问题及了解最新安全信息的门户,受众可常规订阅MedWatch安全警报;MedSun——医疗产品安全网络,通过在全美招募的350名医疗服务提供者,检测医疗产品的安全性和有效性,报告任何导致严重伤害或死亡的医疗问题。FDA每月都会发布MedSun通讯。

FDA定期组织的针对消费者的各类免费公共会议
▷问题报告机制之外,FDA也在发力主动监控——“哨兵计划”。其正在开发一个新的国家系统以更快发现可能的安全问题,其中将包含如各种数据合作伙伴的电子健康记录系统、保险索赔数据库、以及注册管理机构的信息,以实时掌握已批准上市的医疗产品的安全性。
▷在FDA网站上可以看到,其将拥有的各类信息针对不同受众做了分类梳理。比如针对一般消费者,旨在提供保持安全与健康的最新信息;针对患者,则旨在使其了解各种治疗方法,药物/器械批准情况,以及公开会议(FDA举办的免费的咨询委员会会议、公众研讨会等);对于健康专业人员,则提供医疗产品安全信息、不良事件/问题报告等专业信息;以及针对行业的注册指导、进口计划等。
FDA网站首页的信息分类
▷网站上显目的召回信息、问题报告和基础知识等版块,是FDA在信息对称及市场教育上的亮点所在。一个名为“FDA透明度倡议”的类目对此做了介绍,这个倡议于2009年发起,分3个阶段推进信息透明:
第1阶段称作“FDA基础”,于2010年推出了一个基于web的FDA基础知识库,以网络研讨会等形式为公众提供有关FDA的基本信息;
之后第2阶段为“公开披露”,发布了“第2阶段透明度报告”,重点是披露监管产品和企业的相关信息;
第3阶段为“监管行业的透明度”,于2011年发布了第3阶段透明度报告,重点是提高FDA运作和决策的透明度。
严格审批的CFDA
▷伴随中国成为全球第3大医美消费市场,越来越多的国外医美上游药品及器械商都逐渐进入并发力。获得中国的CFDA认证则成了一块必要的敲门砖。
▷CFDA即国家食品药品监督管理总局,监管包括食品(含视频添加剂、保健品)、药品、医疗器械、化妆品等几大领域。
根据官网资料,国产器械及进口器械在申报注册时,需要提供产品综述资料、研究资料、生产制造信息、临床评价资料、产品风险分析资料等,进而经过如下流程完成审批:
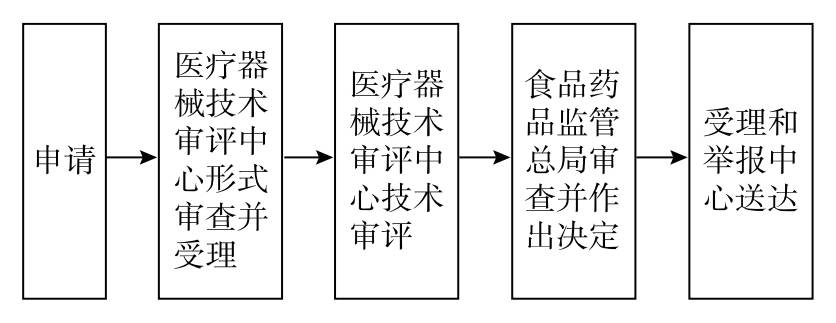
CFDA的医械注册审批流程
▷CFDA中,与医疗器械相关的部门包括医疗器械注册管理司和医疗器械监管司,定期发布“医疗器械质量公告”、“医疗器械不良事件信息通报”、“医疗器械行业标准公告”等。
▷其官网提供三种信息查询方式,包括公众查询、企业查询及标准查询。“公众查询”可以检索国产、进口的药品、器械等的注册信息,及广告情况;“企业查询”则为包含CFDA各类信息的数据库;而在“标准查询”中,则包含了“医疗器械强制性行业标准”等各类标准的信息。


CFDA的企业查询数据库及各类行业标准查询
▷在对部分医美器械商的采访中《美业观察》了解到,CFDA对设备的安全性要求门槛很高,控制严格,企业从研发到取证,周期长投入大。“有可能等你产品要上市了,国外同类设备已经进来卖了很多了,市场空间会变小。”因而在相对有周期性的医美领域,一些国产中小厂商则难以被驱动去投入做这样的研发和取证。
▷一家国外知名医美器械厂商则表示,他们新产品上市之后会立即同步在中国进行注册,完成这一过程一般需要2年左右时间。
▷而由于进入中国市场的先后,国外厂商的产品也在获取CFDA的认证上也存在一个时间差。一些“赛道”中,某些厂商的设备先行进入并完成审批,而获得先发优势占领市场;也有获FDA认证并早已风靡国内的设备(如超声刀),因基于现实情况不可控的安全风险,至今没有获证通行。
▷关于两者的审批和监管,一位国内知名医美器械代理商相关负责人曾对《美业观察》总结差异:类似于中美两国大学“严进宽出”和“宽进严出”的差别,CFDA的特点是“严格审批”,需要在“准入”时考虑到基于当前市场状况各种不可控的操作风险;而相对而言,FDA更主要的特点,则体现产品上市后的“严格监管”上。
本文作者