
将我们全身细胞的DNA抻直,它们能从地球够到冥王星。但是,我们丝毫不清楚,每个细胞中足足2米长的DNA,是如何“塞”到直径只有千分之一毫米的细胞核中的。
如今,科学家们首次展现了人类活细胞核中的染色质的3D结构图——其中DNA与蛋白质的结合清晰可见。
出乎意料的是,他们并未看到课本中所描绘的高度有序的染色质高阶结构(现代生命科学教科书中就有一个经典的DNA凝缩模型,这个模型中包含了几个不同阶段的染色质结构)。另外,决定激活或抑制基因的,并非其他高阶结构,而是染色质自身的组装密度。
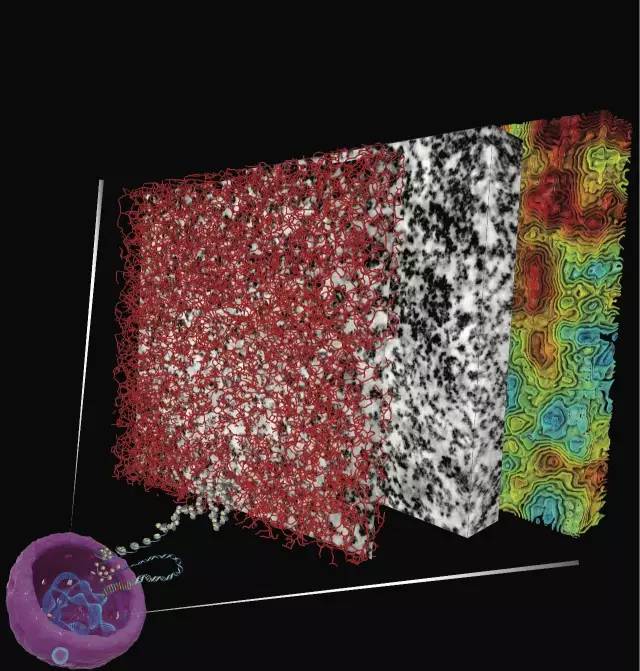
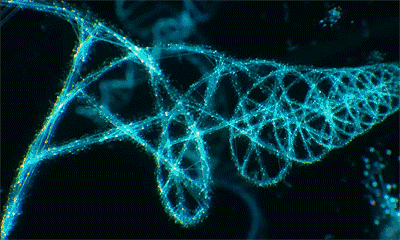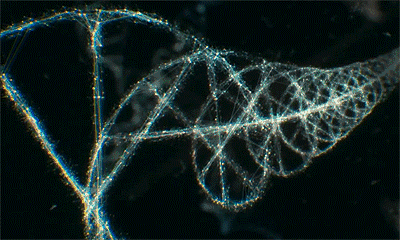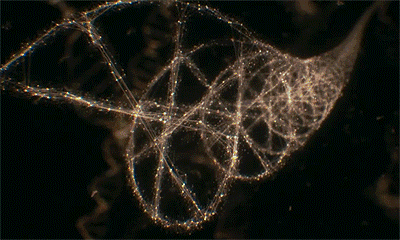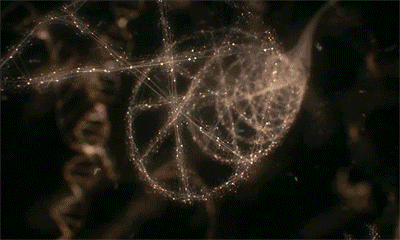
图丨染色质的3D成像图
来自索尔克研究所及加州大学圣迭戈分校的研究小组在 7 月 28 日的《Science》上刊登了这项突破性工作。通过揭示活细胞细胞核染色质的精细结构,这项研究可能将改写课本中有关DNA组织排布的内容,甚至有望创立治疗疾病的新方法。

图丨《Science》封面,值得一提的是,本期封面由金属喷绘而成
“我们证明了染色质并不需要形成离散状态的高阶结构去适应细胞核。”来自索尔克研究所的副教授、本文的通讯作者Clodagh O’Shea说,“调节组装密度,能够改变及限制分子进入染色质,是控制DNA序列的不同结合分子、核小体变形及修饰、改变基因功能活性,实现各个部分及层次精细协调控制的局部及整体结构基础。”
相信大多数人对课本中DNA的双螺旋结构仍有印象。1953年,弗朗西斯·克里克和詹姆斯·沃森发表了著名的DNA双螺旋分子结构。这个发现改变了人们关于生命的理解,也标志着现代生物学的到来。

图丨1953年,詹姆斯·杜威·沃森(James Watson)和弗朗西斯·哈利·康普顿·克里克(Francis Harry Compton Crick)在《Nature》上发表了关于DNA双螺旋结构的论文
自从二人发现了DNA的双螺旋一级结构起,科学家们一直希望获知DNA如何把自己“打包”至细胞核内,在细胞核内的高阶结构中如何组织排布,从而实现在细胞周期的不同时间点严格调控复制的机制。
X射线衍射及显微技术已经为我们展现了染色质的一级结构:由147个DNA碱基对缠绕在直径约11纳米的组蛋白上形成核小体。之后,按照现代生命科学教科书中经典的DNA凝缩模型,这些核小体会像念珠般串联并折叠,形成不连续的、直径更大(30,120,320nm等)的纤维结构,直到形成染色体。
但我们对染色质的一级结构以外的其他高阶结构仍所知甚少。关键问题在于,至今无人在细胞未被裂解及细胞处于不同细胞周期时,观察到过染色质的这种结构,以至于教科书中关于完整细胞中染色质高阶结构的内容仍然仅停留在猜想与理论层次,从未被证实。
在此次研究中,研究人员研发出一种叫做“ChromEMT”(ChromEM tomography,染色体电镜断层拍摄)技术,用以窥视染色质的高阶结构。这是一种将新型的DNA染料与高级显微镜相结合的技术,能够将细胞静止及有丝分裂期的染色质结构高度细节化成像。

图丨负责本次研究的Horng Ou (左)和Clodagh C. O’Shea(右)
为了实现在完整细胞核中染色质的可视化,O’Shea团队筛选了大量不同类型的染料,最终发现其中一种荧光染料能够通过一系列可由光精确调控的化学反应,在DNA表面“涂上”一层金属物质,从而得到在活细胞中DNA聚合体局部3D结构的高清影像。
有了可靠的DNA染料还不够,科学家们还需要性能更加完美的成像技术才能实现对染色质高阶结构的探索。来自加州大学圣迭戈分校的合作团队的显微镜专家、文章共同作者Mark Ellisman教授同样完成了这一艰巨任务。
Mark Ellisman开发了利用电子束与样本间倾斜角重建DNA 3D结构、具有更高级功能的电子显微镜。将O’Shea团队的新型染色质染色技术与这一电子显微镜断层成像技术结合,这一新技术被命名为“ChromEMT”。研究团队利用ChromEMT使处于休止期及有丝分裂中期(此时DNA排布最为致密紧缩)的人类细胞染色质成像。
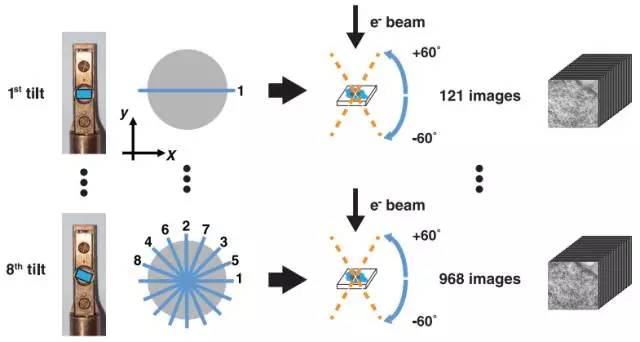
图丨ChromEMT 原理演示图
“教科书中的模型与我们所观察到结果的不一致是有原因的,”本文第一作者,索尔克研究所研究助理Horng Ou说。“以往的观察,是在染色质被提取至试管中后进行的,所以可能会与完整活细胞中的染色质不同,这也说明了体内成像有多么的重要。”
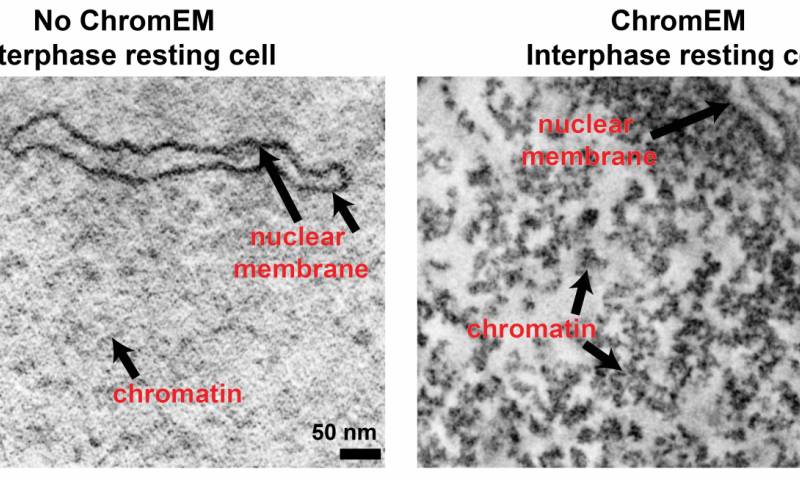
图丨染色质结构决定了人类基因的功能。为了使完整细胞中的染色质显像,ChromEMT技术使DNA表面覆盖金属粉末。被金属包裹染色质在电子显微镜下实现3D成像,揭示了其结构与排布。上图为3D断层扫描时的一层图像。利用ChromEMT技术,我们能够捕捉到染色质的精细结构(右,深色结构),然而未经染色的细胞(左)无法观测到染色质结构。
无论是在静止期还是分裂期的细胞中,研究团队都未观测到理论模型中核小体如“念珠串”组成30或120或320nm的不连续染色质高阶结构。相反,核小体形成了一种半柔性链,根据测量,这一结构的长度在5-24nm范围连续变化,通过折叠弯曲,实现不同程度的压缩聚合。这一发现说明是染色质的组装密度,而非其他高阶结构,决定了基因的激活或抑制。
通过3D结构重建,研究团队可以观察到250nm x 1000nm x 1000nm 范围的染色质弯曲折叠,并且可以实现如RNA聚合酶(参与DNA转录)等大分子,受到染色质密度变化引导,穿越一系列结构,定位到基因组中特定结合位点过程的可视化。除颠覆教科书中的模型之外,这一研究结果表明,控制染色质密度能够实现对特定酶或转录因子与DNA结合的调控,能够成为一种预防、诊断及治疗癌症等疾病的有效手段。
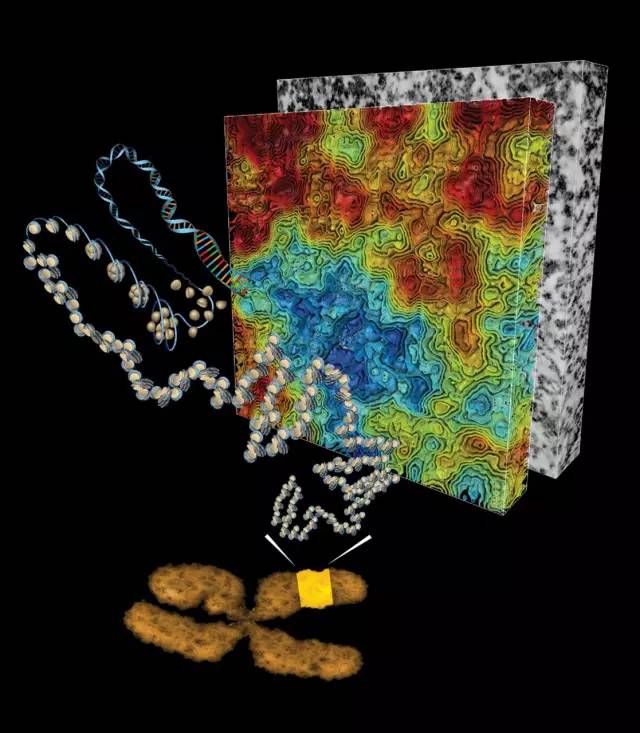
“生物学所面临最艰巨的挑战之一便是探究DNA在细胞核中的高阶结构与基因功能之间的联系,”来自索尔克研究所的副教授、本文的通讯作者Clodagh O’Shea说。
DNA在细胞核内的三维结构如何对生物体产生影响,基因组如何调节细胞活性,基因如何从亲代遗传至子代……这一系列生物领域的核心问题都与细胞核内染色质的结构息息相关。接下来,研究者们将进一步探究这种染色质结构是否具有细胞类型及器官层面的普适性。
或许,教科书的终极命运就是被改写,在未来等待我们的,可能是更多“生命源于无序”的证据。
-End-
参考:
https://phys.org/news/2017-07-scientists-longstanding-biological-mystery-dna.html
http://science.sciencemag.org/content/357/6349/eaag0025
http://www.salk.edu/news-release/salk-scientists-solve-longstanding-biological-mystery-dna-organization/


