近日,世界顶尖科研实验室、现代分子生物学的发祥地之一、拥有数十位诺贝尔奖获得者的英国医学研究理事会(MRC)分子生物学实验室(LMB)在阿尔兹海默病研究领域再次取得重大突破性进展。
研究人员利用冷冻电子显微镜,首次获得了阿尔兹海默病患者脑部Tau细丝的高分辨率分子结构图像。这项突破性的研究,是Tau蛋白在阿尔兹海默病患者脑中被发现三十年以来,科学家首次看清其真实面目,也是近三十年来阿尔兹海默病领域取得的最大进展之一。相关研究成果以封面形式刊登在《Nature》上[1]。

阿尔兹海默病(Alzheimer's disease,AD),是一种常见的神经退行性疾病,也是老龄人口中发病率最高的疾病之一。据国际阿尔茨海默病协会(ADI)发布的报告显示[2],2015年全球新发990万阿尔兹海默病患者,到2050年,全球患有阿尔兹海默病的人数将从目前的4600万人增加至1.315亿人。
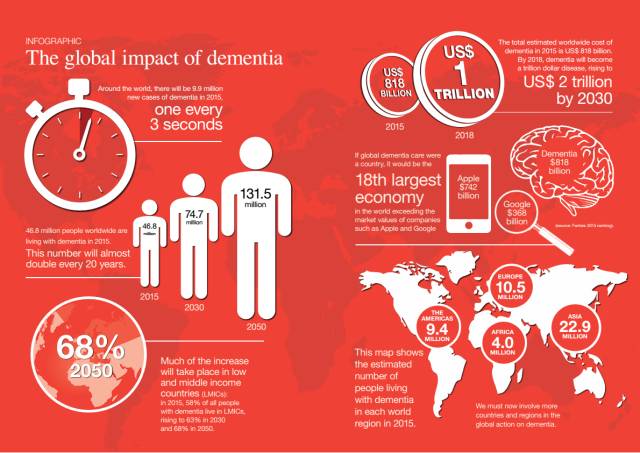
World Alzheimer's Report 2015
与疾病严峻形势严重不相符的是,近年来有关阿尔兹海默病的药物研发,几乎没有取得任何突破性进展。
根据美国药物研究和制造商(PhRMA)年发布的报告显示[3],1998-2015年美国生物医药产业研发的治疗阿尔茨海默病123个新药,最终通过FDA审批上市的新药只有3个(还有一个联合治疗方案),其余全部失败。近两年制药巨头倒在临床III的新药更加惨不忍睹。
阿尔兹海默病的药物研发,已经成为科学史上的一个“巨坑”。然而随着一个个“亲儿子”一样的药物相继“流产”,各国政府和制药巨头不但没有放弃,反而投入更大的资金和精力。其中缘由也很好理解,毕竟能够治愈阿尔兹海默病的药物,意义太重大,利润太诱人!
当然了,之前那么多新药相继失败,也是有原因的。
从1906年阿尔兹海默博士发现该病以来,全世界的科研人员针对阿尔兹海默病进行了广泛而深入的研究。但是一百多年过去了,阿尔茨海默病的确切病因及发病机制仍然是未知的,这也正是目前众多相关药物难以从根本上逆转疾病进展的主要原因。
1988年,MRC分子生物学实验室的研究人员,首次从阿尔兹海默症患者大脑的斑块中发现Tau蛋白形成的细丝,Tau蛋白也因此成为阿尔茨海默病和一系列其他神经退行性疾病的第一位“嫌疑人”[4]。
时隔两年之后,阿尔兹海默病患者脑中的β淀粉样蛋白也被人们发现[5]。并且研究人员在阿尔兹海默症患者身上发现了导致β淀粉样蛋白在大脑聚集的基因突变,因此认为这可能才是导致阿尔兹海默症的原因。
由此,关于阿尔兹海默症的“元凶”,也就形成了两种学说,一种认为在神经细胞外,由β淀粉样蛋白异常沉积形成的淀粉样老年斑,导致了阿尔兹海默病;另一种原因则是由于神经细胞内Tau蛋白自聚集出现的神经纤维缠结(NFTs)引起。
虽然这些病理特征上的认识,并不能作为疾病最原始的发生机制,但是人们起码形成了一个共识,就是阿尔兹海默病患者的脑中出现了非正常的蛋白质积淀。如果能够想办法靶向消除β淀粉样蛋白或Tau蛋白,也许就能够有效治愈阿尔兹海默病,起码能够改善一下病情。
基于这样的一个假设,生怕落后于人的各大制药公司,不惜投入数十亿美元,争先恐后开发靶向β淀粉样蛋白或Tau蛋白的药物。由于机制认识上的不足,也导致目前的这些药物,没有一种能够有效治愈阿尔兹海默病,甚至都无法控制和延缓病情发展。极个别获得批准上市的药物,也只能在一段时间内帮助减轻部分症状。
和这些药企做法不同的是,仍有一群科学家在默默继续着对Tau蛋白的研究。MRC分子生物学实验室的神经生物学主任Michel Goedert,这三十年来一直在与Tau蛋白打交道。
自从1988年他们首次发现阿尔兹海默病与Tau细丝的关系之后,1992年他们又发现了阿尔兹海默病患者脑部Tau蛋白的6种异构体,均由双螺旋丝(PHF)和直丝(SF)构成,长度分别在352-441个氨基酸;1998年,他们发现Tau蛋白基因MAPT的突变,会导致神经退行性病变和痴呆症;2009年,Goedert团队在转基因小鼠中证明了Tau蛋白的聚集会导致朊蛋白类疾病[6]。
但是,Michel Goedert表示,“到目前为止,人脑组织中Tau高分辨率的结构仍然是未知数。”也就是说,这么多年来科学家们还不知道Tau细丝真实的分子结构,那些开发Tau靶向药物的制药公司,原来是在黑暗中狂奔,不停地设计新药,然后不停地测试不同药物对Tau蛋白结构的影响。搞半天,是在拼运气么。
而且以前研究使用的Tau细丝,是从实验室合成的样品。鉴于Tau细丝多样的结构,这些之前研究使用的样品,与阿尔兹海默病患者脑部的Tau细丝对疾病的影响相差几何,更不得而知。
在结构化学中,有一句常讲的话叫做“结构决定功能”。如果无法确定Tau蛋白及细丝各种亚型准确的分子结构,也就无法针对性地设计抑制剂,阻止患者神经元中Tau细丝的形成。
研究人员尝试过X射线晶体成像和核磁共振技术,但这两种技术对样品条件的要求比较高,面对Tau这种独特而又复杂的样品,实在有点无能为力。研究人员将最终的希望放在了当下最火热、最先进的冷冻电子显微镜(Cryo-EM)身上。由于Tau细丝有着平滑的螺旋结构,确定螺旋结构内核的原子分布确实难度不小[7]。
为此,团队还开发了一套叫做RELION(REgularised LIkelihood OtimisatioN)的程序,来对冷冻电镜的数据进行分析计算,从而推断Tau内部的原子排列。最终,研究人员获得了Tau蛋白3.4-3.5Å(长度单位,1 Å =1×10-10米)分辨率的分子结构照片。
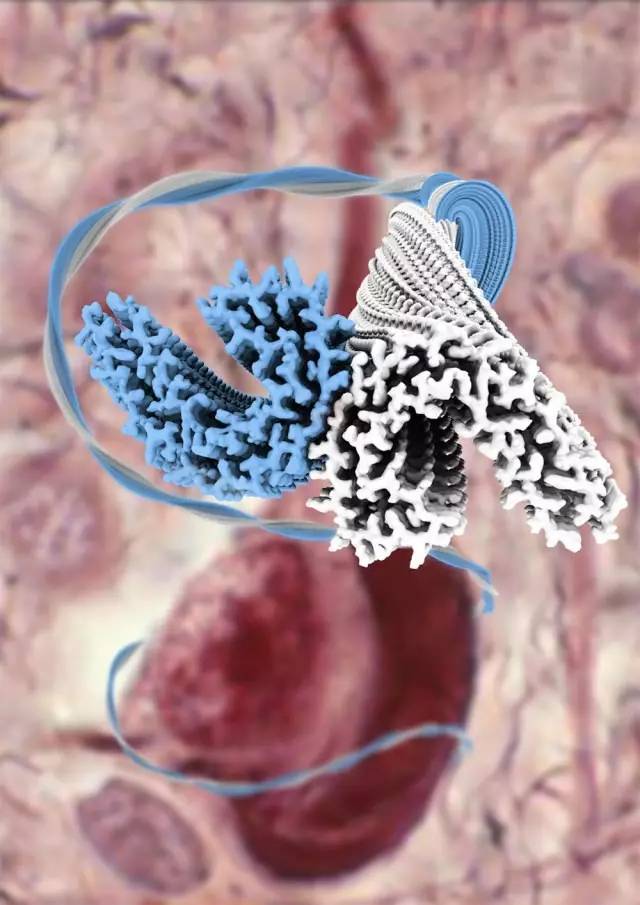
Tau蛋白聚积形成的双股螺旋细丝结构
看清楚来自阿尔兹海默症患者脑部Tau细丝的分子结构,将会允许科学家了解究竟Tau的哪部分结构导致了聚集反应,从而更好地开发药物来阻止这一过程。
MRC分子生物学实验室的负责人,也是此次研究论文的通讯作者Scheres表示,“在不同的神经退行性疾病中Tau细丝结构并不相同,我们想了解它们在原子层面的差异,这除了帮助我们了解这些疾病之间的差异,也潜在地开启了基于机制的治疗方法。”
MRC首席科学官Rob Buckle博士说:“这项突破性的工作是对我们对阿尔茨海默病的理解的重大贡献。三十年前,LMB的科学家们首先发现Tau蛋白在疾病中起关键作用。如今了解Tau蛋白在患病组织中的基本结构,对于疾病诊断和治疗的药物开发至关重要。”
另外,这项研究也开辟了利用Cryo-EM研究一系列其他相关疾病的可能性,包括帕金森病、运动神经元疾病和朊蛋白类疾病(神经系统变性疾病)。那是不是也应该给β淀粉样蛋白拍张原子级别的Cryo-EM照片了?

阿尔兹海默病:上帝恶毒的诅咒
参考资料:
[1] http://www.nature.com/nature/journal/v547/n7662/full/nature23002.html
[2] World Alzheimer's Report 2015: Global Impact of Dementia. Medscape. August 27, 2015
[3] http://www.phrma.org/
[4]Wischik CM, Novak M, Edwards PC, Klug A, Tichelaar W, Crowther RA. 1988. Structural characterization of the core of the paired helical filament of Alzheimer disease. Proceedings of the National Academy of Sciences 85:4884-8
[5] Masters CL, Bateman R, Blennow K, Rowe CC, Sperling RA, Cummings JL. 2015. Alzheimer's disease. Nature Reviews Disease Primers:15056
[6] http://www2.mrc-lmb.cam.ac.uk/first-atomic-structures-tau-filaments-alzheimers-disease-brain/
[7] https://www.laboratoryequipment.com/article/2017/07/first-time-scientists-image-structure-tau-filaments
本文经公众号“奇点网”(ID: geekheal_com)授权转载,版权归原作者所有。
《阿尔茨海默病分子生物学》
随着全球老龄化的进展,阿尔茨海默病作为一种严重危害老年人健康的神经退行性疾病,已日渐广受关注。目前,国内鲜有阐述阿尔茨海默病分子生物学方面的书籍,故本书就这一领域进行全面科学的论述,具有重要的学术价值。全书分为二十二章,对阿尔茨海默病发病机制的主要假说及可能存存的分子生物学机制都进行了比较全而详细的论述,包括:胆碱能学说、A B学说、Tau蛋白学说、糖代谢异常、脂质代谢紊乱学说、脑血管病学说、分子遗传学说;糖原合成酶激酶3、AMPK、线粒体损伤在阿尔茨海默病中的作刚机制;神经炎症、氧化虑激、神经凋亡、小胶质细胞、星形胶质细胞、少突胶质细胞、硫化氢、微RNA以及长链非编码RNA与阿尔茨海默病的关系;阿尔茨海默病早期诊断的生物学标志物及其转基因动物模型。对阿尔茨海默病分了生物学领域进行了伞面前沿的阐述,为阿尔茨海默病发病机制及临床提供了科学依据。
(本期责编:李文超)
原创好读 科学品味