前些日子,由上海市第一人民医院主办的“2016年上海食管疾病诊治论坛”在交大医学院隆重召开。在会议上,上海市第一人民医院消化内科宛新建教授作了《早期食管癌的内镜诊疗》的报告,对早期食管癌内镜诊疗进行了非常精彩的介绍,小编在这里简要整理,以飨读者。
来源:医学界消化频道
作者:橙子
审稿:赵洪礼
什么是早期食管癌?
早期食管癌 (early esophageal cancer):目前国内较为公认的定义指病灶局限于黏膜层和黏膜下层,不伴有淋巴结转移的食管癌。
早期食管癌如何分型?
早期食管癌及癌前病变的内镜下分型
依照 2002 年巴黎分型标准和 2005 年巴黎分型标准更新版,表浅型食管癌及癌前病变 (Type 0) 分为隆起型病变 (0-Ⅰ)、平坦型病变 (0-Ⅱ) 和凹陷型病变 (0- Ⅲ )。0-Ⅰ型又分为有蒂型 (0-Ⅰp) 和无蒂型 (0-Ⅰs)。

图 早期食管癌内镜下分型(巴黎分型,2005年)
早期食管癌及癌前病变的病变层次分类
病变仅局限于上皮内,未突破基底膜者,为M1(原位癌/重度异型增生;Tis);早期食管癌分为黏膜内癌和黏膜下癌:黏膜内癌分为M2和M3;M2 指病变突破基底膜 , 浸润黏膜;M3指病变浸润黏膜肌层。黏膜下癌根据其浸润深度可分为 SM1、SM2、SM3, SM1指病变浸润黏膜下层上1/3;SM2指病变浸润黏膜下层中 1/3;SM3指病变浸润黏膜下层下1/3。对于内镜下切除的食管鳞癌标本,以 200 μm作为区分黏膜下浅层和深层浸润的临界值。
病变内镜下形态与病变层次的关系
黏膜内癌通常表现为0-Ⅱb型、0-Ⅱa 型及0-Ⅱc型,病灶表面光滑或呈规则的小颗粒状;而黏膜下癌通常为0-Ⅰ型及 0-Ⅲ型,病灶表面呈不规则粗颗粒状或凹凸不平小结节状。我国学者将早期食管癌病理形态分为隐伏型 (充血型)、糜烂型、斑块型和乳头型 , 隐伏型多为原位癌;糜烂型大部分为原位癌,部分为早期浸润癌,癌细胞分化较差;斑块型最多见,大部分为早期浸润癌,癌细胞分化较好;乳头型主要为早期浸润癌,癌细胞分化一般较好。

表 消化道上皮肿瘤维也纳分型(修订版)
早期食管癌内镜诊疗有哪些不同的方法呢?
普通白光内镜
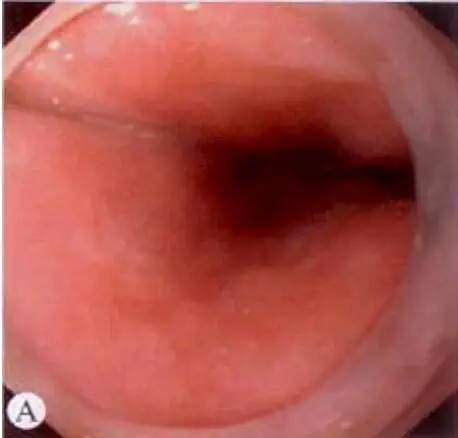
充血型:黏膜平坦,小片状不规则充血,与整肠黏膜接线不清,质脆,触之易出血,管腔壁蠕动正常。
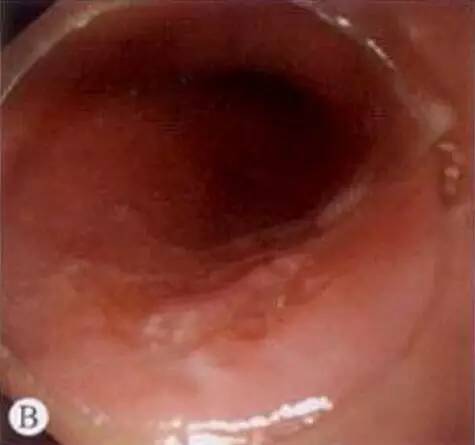
糜烂型:最常见,约占45%;病变黏膜在充血基础上出现中央轻度凹陷,边界清晰,呈不规则的地图样,有点片状糜烂或浅溃疡。表面覆薄苔,质脆,管腔尚柔软。
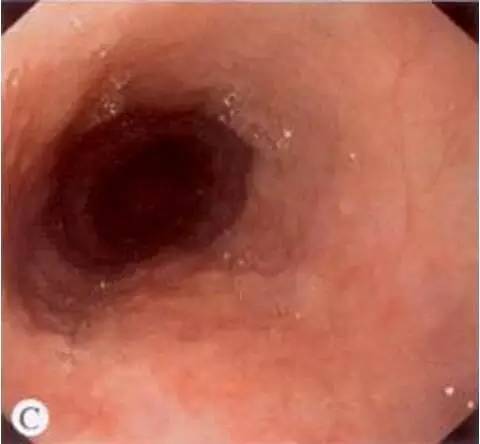
斑块型:病变黏膜变白,表面轻度隆起,粗糙不平,呈颗粒样改变,质脆,较大病灶可伴有浅表溃疡。
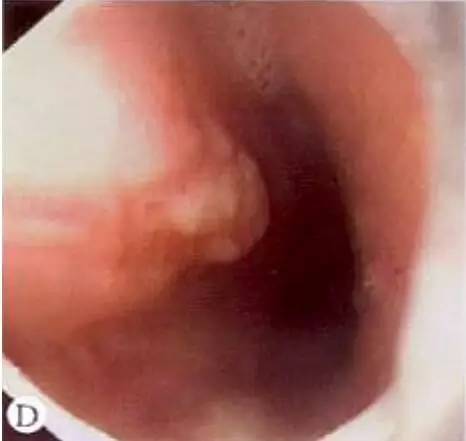
乳头型:最少见;病变黏膜不规则增厚,呈乳头样,小结节息肉样隆起,直径<1cm,基地宽,表面充血、糜烂,偶有出血。
溃疡型:溃疡基底部坏死组织蚀厚,表面高低不平,易出血。边缘组织有不规则增生,呈虫蚀状或小结节状隆起。
色素内镜
卢戈氏碘染色:正常鳞状上皮细胞含大量糖原,遇碘反应呈棕褐色;而糖原被癌细胞或异型细胞消耗殆尽时不染色。根据病变着色深浅、范围及边缘形态 , 进行指示性活检 , 可提高高危人群早期鳞癌及异型增生的检出率 。该法不适用于碘过敏、甲亢患者。
I级——浓染区,比正常食管黏膜颜色深,多见于糖原棘皮症;
Ⅱ级——正常表现,呈棕褐色;
Ⅲ级——淡染区,多见于LGIN或急慢性炎症;
Ⅳ级——不染区,多见于浸润癌、原位癌和HGIN。
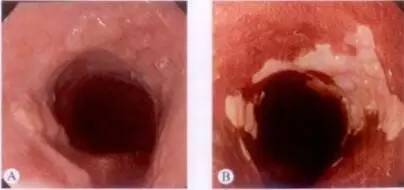
图 早期食管癌,结节样隆起区域(Ⅰ型)碘染色不染
A.早期食管癌,结节样隆起区域(Ⅰ型);B.卢戈液染色后,病变不染,边界清晰

图 早期食管癌,轻微隆起,白色区域(Ⅱa型)碘染色不染
A.早期食管癌,轻微隆起,白色区域(Ⅱa型);B. 卢戈液染色后,病变不染,边界清晰
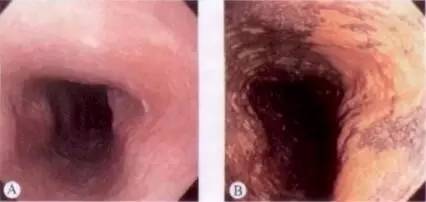
图 早期食管癌,稍红、平坦区域(Ⅱb型)碘染色不染
A.早期食管癌,稍红、平坦区域(Ⅱb型)B. 卢戈液染色后,病变不染,边界清晰
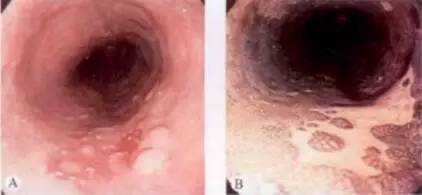
图 早期食管癌,轻微凹陷,结节样不整区域(Ⅱc型)碘染色不染
A. 早期食管癌,轻微凹陷,结节样不整区域(Ⅱc型);B. 卢戈液染色后,病变不染,边界清晰
内镜窄带成像技术(NBI)
内镜窄带成像技术(Narrow-band imaging,NBI)是一种新兴的内镜技术,利用滤光器滤掉内镜光源所发出的红、蓝、绿光波中的宽带光谱,仅留下窄带光谱用于诊断消化道各种疾病。NBI将上皮乳头内毛细血管(intrapapillary capillary loops, IPCL)和黏膜的细微变化显现出来。NBI能够对食管早期病变进行初步的组织学诊断,对病变的靶向活检具有指导意义。
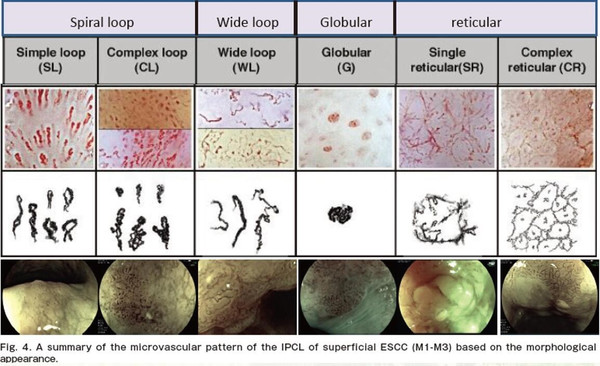
图 基于形态学表型的浅表食管鳞状细胞癌IPCL的形态汇总
超声内镜(EUS)
超声内镜(Endoscopic ultrasonography,EUS):通过显示肿瘤侵犯食管壁5层结构的深度和范围,周围器官和淋巴结有无转移,对病灶进行定性诊断,被认为是目前对食管癌TMN术前最准确的方法之一,为食管癌分型、分期和制定方案提供依据。超声内镜在判断食管癌浸润深度的准确率为75%——95%,判断其周围淋巴结转移的准确率为41.2%。
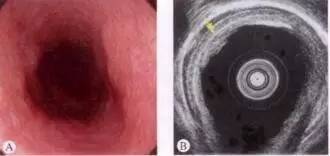
图 食管黏膜内癌,A为食管扁平隆起(Ⅱa型),B为EUS下低回声病灶局限于黏膜层
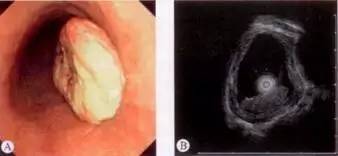
图 食管黏膜下癌,A为内镜下见食管肿块,B为EUS下低回声病灶来源于黏膜层,侵犯黏膜下层
内镜下切除治疗技术有哪些呢?
内镜下黏膜切除术(EMR)
内镜下黏膜切除术(EMR):指内镜下将黏膜病灶整块或分块切除 , 用于胃肠道表浅肿瘤诊断和治疗的方法。
透明帽吸引法黏膜切除术(EMRC)
透明帽吸引法黏膜切除术(EMRC):利用内镜前端安置的透明帽对病变进行吸引,再行圈套切除,对操作技术要求不高,并发症少,目前较为常用。缺点是可切除的病变大小受透明帽限制。
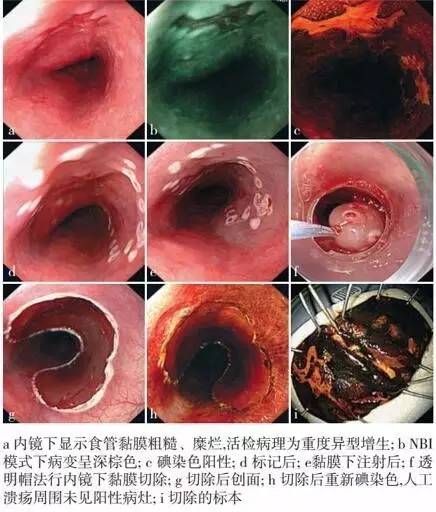
内镜下分片黏膜切除术(EPMR)
内镜下分片黏膜切除术(EPMR):在应用EMR治疗上消化道黏膜层肿瘤时,直径<2 cm的病变可以直接利用EMR进行切除,对直径>2c m水平生长型肿瘤或无蒂隆起型肿瘤可以采取分片切除的方法,即在EMR基础上发展而来。它是利用EMR技术对病变进行反复多次的圈套切除,是消化道大范围早期癌和癌前病变的最主要内镜治疗技术,但是EMR的切除范围及深度均有限,EPMR存在残留率及复发率高、电凝切除后标本破碎组织边缘病理检查困难等不足。
内镜粘膜下剥离术(ESD)
内镜粘膜下剥离术(ESD):是在进行黏膜下注射后使用特殊电刀逐渐分离黏膜层与固有肌层之间的组织 , 将病变黏膜及黏膜下层完整剥离的方法。
操作步骤 : ①病灶周围标记;②黏膜下注射,使病灶充分抬举;③环周切开黏膜;④黏膜下剥离,使黏膜与固有肌层完全分离开, 一次完整切除病灶;⑤创面处理:包括创面血管处理与病灶边缘检查。
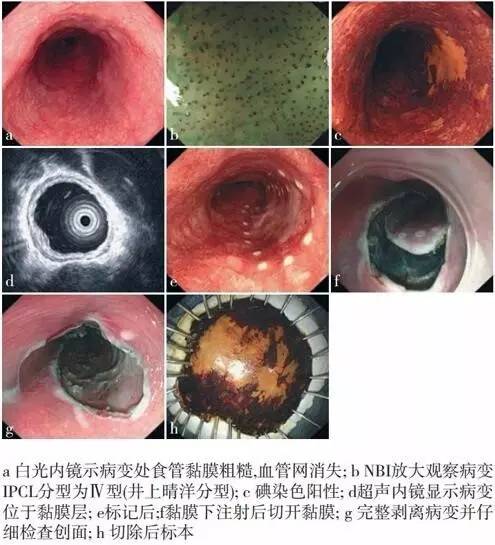
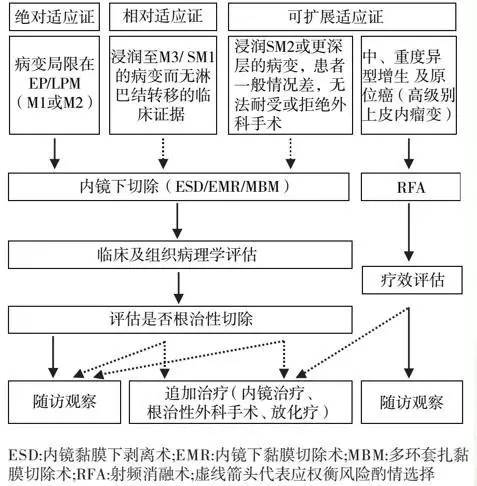
早期食管癌内镜下切除的适应证与禁忌证
日本食道学会 (JES)2012 年颁布的食管癌诊治指南推荐早期食管癌内镜下切除内镜下切除治疗的绝对适应证:病变局限在上皮层或黏膜固有层的 T1a 期食管癌,淋巴结转移风险极低,内镜下切除可获得根治。内镜下切除治疗的相对适应证:病变浸润黏膜肌层 (M3) 或黏膜下浅层(T1b-SM1, 黏膜下浸润深度 <200 µm); 黏膜下浸润深度超过 200 µm 的病变发生淋巴结转移的风险高,建议采取与进展期肿瘤相同的处理方式 。
国内较为公认的早期食管癌和癌前病变内镜下切除的绝对适应证:病变局限在上皮层或黏膜固有层 (M1、M2); 食管黏膜重度异型增生。内镜下切除的相对适应证 : 病变浸润黏膜肌层或黏膜下浅层 (M3、SM1), 未发现淋巴结转移的临床证据 ; 范围大于 3/4 环周、切除后狭窄风险大的病变可视为内镜下切除的相对适应证 , 但应向患者充分告知术后狭窄等风险。
内镜下切除的禁忌证 : 明确发生淋巴结转移的病变 ; 若术前判断病变浸润至黏膜下深层 , 有相当比例患者内镜下切除无法根治 , 原则上应行外科手术治疗 ; 一般情况差、无法耐受内镜手术者。内镜下切除的相对禁忌证 : 非抬举征阳性 ;伴发凝血功能障碍及服用抗凝剂的患者 , 在凝血功能纠正前不宜手术 ; 术前判断病变浸润至黏膜下深层 , 患者拒绝或不适合外科手术者。
早期食管癌的内镜下非切除治疗
射频消融术 (RFA)
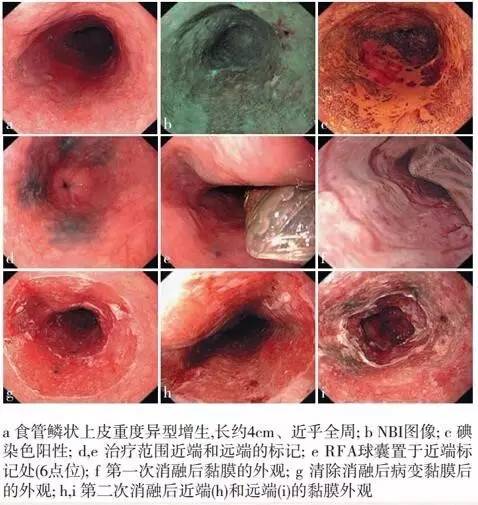
射频消融术 (radiofrequency ablation, RFA)利用电磁波的热效应发挥治疗作用 , 使组织脱水、干燥和凝固坏死从而达到治疗目的 , 在多发、病变较长或累及食管全周的早期食管癌及其癌前病变的治疗中具有明显的优势 , 作用均匀且其治疗的深度控制在 1000 µ m 左右 , 降低了穿孔和术后狭窄的发生率。初步研究结果显示 ,RFA 可用于Ⅱb 型病变 , 且治疗前活检证实为食管鳞状上皮细胞中度异型增生和 ( 或 ) 重度异型增生及局限于 M2 层的中 - 高分化鳞癌。符合条件的早期食管鳞癌及其癌前病变 RFA 术后 12 个月完全缓解率可达 97%。
但 RFA 对早期平坦食管鳞癌疗效的大样本量研究尚缺乏 , 长期疗效需进一步验证。环周型消融系统多应用于多发、延伸较长或环周病变的治疗 , 治疗过程包括记录消融位置、测量食管内径、置入消融导管进行消融等步骤 , 依据病变及第一次消融情况 ,可在清除已消融病变黏膜后行第二次消融。
早期食管癌内镜治疗流程图
早期食管癌筛查及内镜精查流程图

(文章内容来自宛新建教授讲座报告,文中略有删减)
欢迎投稿到小编邮箱:liushiyi@yxj.org.cn 来稿邮件主题为:【投稿】医院+科室+姓名
小编微信:choudan110
 )
)






























我来说两句排行榜