默克/辉瑞3月24日宣布,FDA批准Bavencio(avelumab)20mg/ml注射液上市,用于治疗12岁以上青少年及成人转移性默克尔细胞癌患者。
Bavencio获得过FDA授予的突破性药物资格,此次是凭借应答率和应答持续期数据以优先审评的方式获得FDA加速批准,是全球第4个上市的PD-1/PD-L1类药物,也是第一个获批治疗转移性默克尔细胞癌的PD-L1单抗。
以PD-1为代表的肿瘤免疫治疗药物市场巨大,BMS、默沙东、罗氏厮杀正酣。默克/辉瑞一早便精确定位,从无人竞争的默克尔细胞癌入手,成功抢到PD-1/PD-L1战场门票,比阿斯利康durvalumab还提前一步上市(推荐阅读:PD-1肺癌市场战局已定,其他适应症战况如何?)。
O-K-T全球季度销售数据(亿美元)
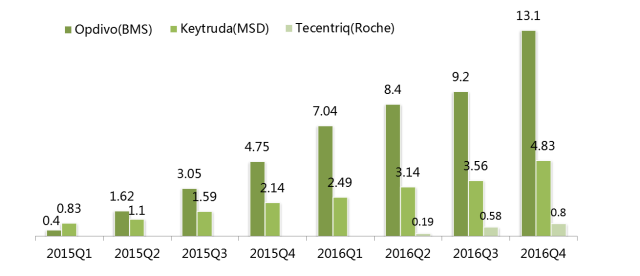
注:Tecentriq销售额单位为亿瑞士法郎
转移性默克尔细胞癌是一种罕见的侵袭性皮肤肿瘤,确诊后1年生存率低于50%,5年生存率低于20%。Avelumab的疗效和安全性在一项代号为JAVELINMerkel 200的单臂、开放、多中心研究中得到证实。
JAVELIN Merkel 200研究纳入88例经组织病理学确认且接受化疗后进展的转移性默克尔细胞癌患者,65%接受过一种疗法,35%接受过2种以上疗法,给予每2周1次avelumab 10mg/kg治疗,直至疾病进展或出现不可耐受毒性。
结果显示,总应答率为33%,其中11%为完全缓解,22%为部分缓解。产生应答的患者中,有86%可持续6个月以上,45%可持续12个月以上,应答持续期为2.8~23.3个月。最常见的不良反应包括疲劳(50%),骨骼及疼痛(32%),腹泻(23%),恶心(22%),注射部位反应(22%),疹(22%),食欲减退(20%)和外周性水肿(20%)。
Avelumab的全球临床开发项目JAVELIN开展了至少30项研究(包括9项III期研究),涉及超过4000例患者,覆盖至少15种肿瘤。由于Avelumab在肺癌领域的开发进度落后对手太多,默克/辉瑞3月初还大幅修改了肺癌III期研究方案,入组人数增加了1倍,(见:PD-1市场竞争激烈,辉瑞/默克大改avelumab试验方案)。
 )
)





























我来说两句排行榜