小编这么拼化学教育期刊
三氧化硫分子杂化轨道的探讨
荣成 蒋疆
(福建农林大学应用化学系 福州 350002)
摘要
分别选用量子化学从头算MP2、QCISD、CCSD法和密度泛函B3LYP方法,在6-311++G(3df,3pd)基组水平下对SO3分子的结构进行了优化比较,结果显示QCISD/6-311++G(3df,3pd)条件下的计算结果最优。在此条件下,用自然键轨道理论(NBO)对SO3分子的杂化轨道、杂化方式、离域π键进行了研究。结果表明S原子采取sp2等性杂化,杂化后形成含3对电子的sp2轨道和1个空的3pz轨道,O原子采取sp3不等性杂化。S与O原子之间的σ键为S→O配位键,3个O原子各1对2pz孤对电子与S原子的3pz空轨道形成π64离域π键。Mayer键级显示S=O键级为1.77,呈现明显的双键特性。
关键词
杂化轨道;离域π键;量化计算;自然键轨道
在“杂化轨道理论”的教学中,教材中提到SO3的中心S原子采取sp2等性杂化,但对具体的杂化过程,一般化学教材中都没有提及,致使很多学生不理解S原子是如何采取sp2等性杂化的。我们知道S原子的价层电子构型为3s23p4,根据教材中的等性杂化的概念,在杂化过程中,3s和3p轨道电子必然要发生重新排列,且每个sp2轨道中的s和p成分相同,每个杂化轨道所含有的电子数也应相同。事实上,20世纪80年代以来,就陆陆续续有学者利用量子化学的方法,对S原子的杂化轨道进行研究[1-2]。Patterson等通过广义价键法(GVB)的计算表明SO3中S原子的3d轨道参与了杂化[3]。张桂玲和戴柏青的研究认为SO3中的S原子采取了sp2和sd2等2种杂化方式[4]。冯传启通过群论方法计算表明SO3中的S原子存在df2杂化[5]。但是,所报道的文献都只讨论了杂化类型,并没有对杂化后的电子排布及成键情况进行讨论。也就是说对于这样一个问题并没有给出确切的答案:即S原子中的3s和3p轨道电子应该如何重新排列而使杂化后的每个sp2轨道电子数相同呢?本文试图利用量化计算方法结合自然键轨道理论(NBO)对SO3的杂化轨道进行计算,并对杂化形式和杂化后的电子填充情况进行解释。
1计算方法
量化计算方法种类很多,每一种方法都有其优、缺点以及相应的误差。为了选出最合适的计算方法,本文选用常用的重头算(ab initio)以及密度泛函(DFT)方法即MP2、QCISD、CCSD和B3LYP,在6-311++G(3df,3pd)基组水平下,利用Gaussian 09程序[6]对SO3的结构进行优化,并将优化后的键长、键角与实验值进行比较,与实验值最接近的那种方法将作为最佳方法用来进行后续的相关计算。自然键轨道(NBO)理论可以用来分析分子的杂化轨道及成键情况,本文利用NBO 5.0程序来进行相关的计算[7]。NBO理论是基于一套数学算法,将电子波函数的薛定谔方程转化成易于理解的传统化学键的概念。根据Pauling的杂化轨道理论,化学键是由原子的杂化轨道组成的。在NBO理论体系中,原子轨道(AO)的密度矩阵通过数学变换后得到自然原子轨道(NAO),同一原子的若干NAO轨道线性组合成自然杂化轨道(NHO),若干原子(通常是两原子)的NHO轨道线性组合形成NBO轨道。也就是说NBO由自然杂化轨道组成,因此可以很方便地通过NBO计算来分析分子中的杂化轨道形式。
2结果与讨论
2.1 SO3分子的优化
通过上文谈到的4种计算方法分别对SO3结构进行优化,结果见表1。优化结果显示,4种方法所得到的SO3的键角均为120°,与实验值完全一致。4种方法得到的键长也较为接近,其优化的键长大小顺序为MP2>B3LYP>QCISD>CCSD。SO3中的S—O键长的实验值为1.4198 Å[8],与此值最为接近的值为1.4161 Å,对应的优化方法为QCISD,即相对来说QCISD在这4种方法中所得到的结果与实验值最为接近,所以后续计算都以QCISD/6-311++G(3df, 3pd)作为计算依据来进行。
表1 SO3键长、键角的优化值

2.2 SO3杂化轨道分析
SO3的杂化轨道计算结果见表2。计算结果表明SO3分子中存在3个S—Oσ键,分别是BD (1)S1—O2,BD (1)S1—O3,BD (1)S1—O4。这3个σ键中S1原子采取的杂化轨道均是sp1.94 d0.08,很显然,d轨道参与了杂化,但含量很低,主要杂化形式可以近似认为是sp2杂化。与计算得到的自然原子轨道(NAO)联系起来,可以得出S原子中参与杂化的s和p轨道分别为3s,3px和3py轨道。表2数据也显示S原子参与杂化后,价层没有孤对电子存在,而且3个杂化轨道的能量均为 -1.379 3 a. u.。杂化轨道的成分相同,能量相同,因而可以证明中心S原子采取的是sp2等性杂化。与S形成σ键的O原子为sp2.82d0.05,同样的d含量成分低,可以近似认为O原子采取的是sp3杂化。与S原子不同的是,O2,O3和O4原子杂化完后,依然存在孤对电子,且孤对电子对应的能量与杂化轨道的能量也不完全相同,因而可以说明O原子采取的是sp3不等性杂化。
另外值得注意的是,在SO3分子中除了上述3个σ键外,还有一个BD(2)S1—O2的π键,构成该π键的S原子采取的是pd0.07的杂化方式,p成分占据93.17%,d成分占6.61%。对照NAO数据,可知p轨道为S的3pz轨道。构成π键的O2原子的p轨道成分高达99.05%,进一步分析也显示其p轨道为2pz。显然,SO3结构中除了杂化轨道形成的σ键外,还存在一个π键。那么,在SO3分子中一共就有4条键了。这就产生了一个问题,即成键情况与教材中所讲的有差异。教材中所讲到的SO3是由3条σ键与1个π64离域键构成。另外,我们回头看O原子形成sp3杂化后的孤对电子数目,可以发现O2有2对孤对电子,O3和O4各有3对孤对电子。O2少的1对孤对电子参与了S1=O2 π键的形成,因为在S1=O2 π键中,O2的成分高达80.47%,可以说这个π键主要来源于O2的2pz孤对电子的贡献。如果这样考虑,那么O2,O3和O4应该都是3对孤对电子。要使O原子sp3杂化后形成3对孤对电子,那么O的杂化轨道情况应该是 O,也就是O原子在杂化过程中,2个p轨道上的单电子被压缩在1个p轨道里,形成3对孤对电子,从而空出1个轨道。O的空轨道要与S形成σ键,那必然形成的是S→O配位键。由于S→O配位键的存在,而且是3个等性的S→O配位键,那就可以推出S原子采取的sp2杂化方式应该是 , 杂化之后,S原子剩余的1个空轨道为3pz轨道。
表2 SO3杂化轨道构成


2.3 SO3分子中离域π键分析
观察LP(3)O3和LP(3)O4孤对电子的占据数,可以发现其值均为1.6968,严重偏离2.0的理论值。说明O3和O4的孤对电子存在着强烈的离域。另外,BD* (1)S1—O2,BD*(2)S1—O2,BD*(1)S1—O3和BD*(1)S1—O4反键轨道电子占据数都超过了0.1,甚至BD*(2)S1-O2的电子占据数达到了0.455 8,进一步证明SO3体系中除了定域的σ键外,一定存在严重的电子离域,否则S—O反键轨道上不可能有不可忽略的电子占据数。电子离域程度可以用二阶微扰稳定化能E(2)的大小来说明,E (2)越大,表示电子离域程度越大。表3列出了SO3分子中O孤对电子的E (2)分析。
表3 O孤对电子二阶微扰稳定化能分析

从表3可以看出,LP(3)O3和LP(3)O4孤对电子的E(2)能量达到97.92 kal·mol-1,表明LP (3)O3和LP(3)O4中的孤对电子向BD*(2)S1—O2强烈离域。L(3)O3和LP(3)O4孤对电子所在轨道的主要成分均为2pz轨道,BD*(2)S1—O2主要成分为π*S1(3pz)—O2(2pz),也就是说这种电子离域属于nO-π*(S1—O2)离域。这种孤对电子向π*轨道的离域导致π* (S1—O2)轨道电子占据数达到0.4558。
考虑到SO3分子中存在着强烈的电子离域,所以,利用NBO程序对SO3分子的共振结构进行了计算。发现SO3分子中存在3种等效共振结构,其共振结构如图1(a)—(c)所示。在每个共振结构中都存在一个等效的S=O π键,那么把具有3个等效π键的共振结构合并,就得到实际SO3的分子结构,如图1(d)所示。
图1 SO3分子的共振结构(a), (b), (c)与实际结构(d)
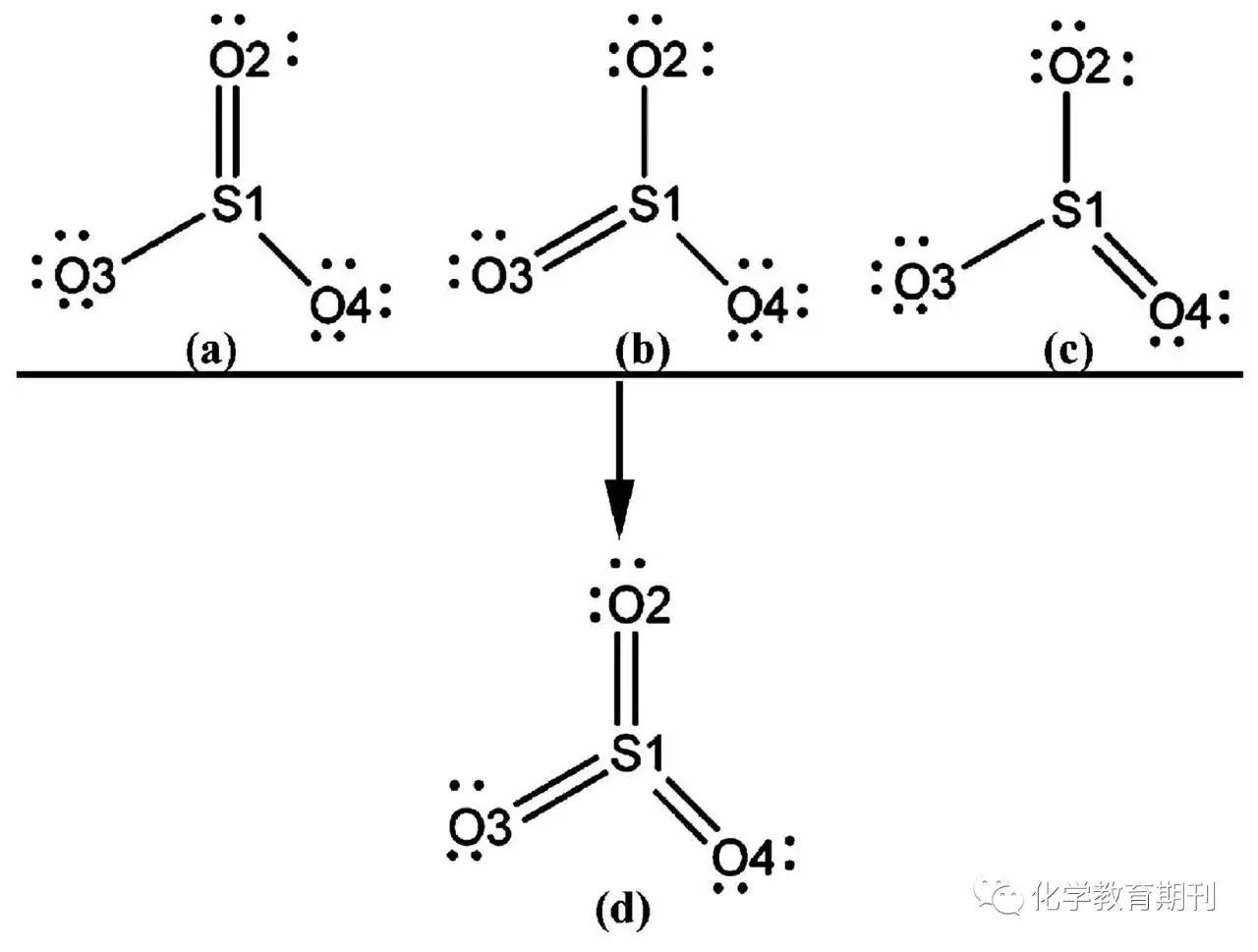
3个等效共振π键的存在,使得围绕中心S原子构筑起了4中心的离域π键。该离域π键是由3个氧的各一对2pz孤对电子与S原子的空3pz轨道耦合而成。由表2可知,π(S1—O2)的电子占据数为1.9980,由于3个共振π键是等效的,所以另外两个共振π键的电子占据数也应为1.9980,故参与构建离域π键的电子数为3×1.9980≈6,此结果表明SO3分子中存在的离域的π键是π64。进一步分析SO3的Mayer键级,可以发现S1—O2,S1—O3,S1—O4的键级均为1.77,这个值已经快接近2了,从而更加确切地证明SO3分子中S与O之间的键具有明显的双键特性。
3结论
从以上的分析可知,SO3分子中S原子采取sp2等性杂化,并有少量3d成分参与了轨道杂化。每个sp2轨道中都有1对电子,空余的3pz轨道参与形成离域π键。O原子采取的是sp3不等性杂化,其中前3个sp3轨道各有1对孤对电子,剩余1个空轨道。S—Oσ键实际上是S→O σ配位键。3个氧原子的各1对2pz孤对电子与S原子的空3pz轨道耦合形成了π64离域π键。另外,Mayer键级分析显示SO3分子中3个S=O键级均为1.77,进一步证实了S与O共价键具有显著的双键特性。
参考文献
[1] Mayer I.J. Mol. Struct. Theochem., 1987, 149:81-89
[2] Yadav A, Surján P R, Poirier R A. J. Mol. Struct. Theochem.,1988, 165:297-307
[3] Patterson C H, Messmer R P. J. Am. Chem. Soc.,1990, 112 (11):4138-4150
[4] 张桂玲,戴柏青.化学通报,2000, 63 (10):46-49
[5] 冯传启.湖北科技学院学报,1989, (2):77-78
[6] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09 (Revision D.01), Gaussian Inc.:WallingfordCT, 2013
[7] Glendening E D, Badenhoop J K, Reed A E, et al. NBO 5.0, Theoretical Chemistry Institute, University of Wisconsin:MadisonWI, 2001
[8] Kaldor A, Maki A G. J. Mol. Struct.,1973, 15 (1):123-130
| 引用本文: |
荣成, 蒋疆. 三氧化硫分子杂化轨道的探讨[J]. 化学教育(中英文), 2017, 38(12): 72-75 |

《化学教育》是教师专业发展的好参谋、好助手、好伙伴!
补订2017年《化学教育》办法
国家级全国中文核心期刊
栏目整合 印刷换新 品质提升
权威、客观、全面、实用
《化学教育》是中国科学技术协会主管,中国化学会、北京师范大学共同主办的国家级全国中文核心期刊,被北京大学《中文核心期刊要目总览》2008版、2011版和2014版连续收录,排同类期刊第1名;美国化学文摘(CA)收录源期刊。
《化学教育》为半月刊,全年共计24期,每期16元,全年共计384元。为了保证能及时收到期刊,由中国邮政承担订阅及投递服务。
订阅方式1:请到当地就近邮局的报刊订阅窗口办理,邮发代号为2-106。
订阅方式2:微信订阅,请扫描下方的二维码,进入订阅页面,按照步骤依次操作:选择投送地区—填写订阅份数—单击立即购买—提交订单—(如果首次操作,请按照提示添加详细可靠的收获地址)—确认订单—微信支付,即可完成订阅。请记住CNSI开头的订单号,以便查询,由“中国邮政”微信公众服务号提供查询和客户服务,全国统一客服电话:11185-9-2。
立即扫码订阅
有化学课程的地方,就应该有《化学教育》期刊!
微信征稿:观点评述、教学案例、教学心得、微课视频、实验视频、趣味实验、活动报道、科普文章、论文交流、人物事迹、试题评析等,新鲜、热门、有趣、实用,统统都可以,让分享促进你我成长,让传播增强化学力量!如果文章阅读人数超过3000,朋友圈分享人数超过300,则赠送1套全年《化学教育》!投稿邮箱:lichuan1099@126.com,邮件主题请写明“微信投稿”。鼓励原创,若参考了他人的文章,请注明来源,以免引起抄袭和剽窃的争议。

 )
)






























我来说两句排行榜