7月19日,自噬研究领域期刊Autophagy在线发表了中国科学院昆明动物研究所题为Atg5- and Atg7-dependent autophagy in dopaminergic neurons regulates cellular and behavioral responses to morphine的论文。该研究首次阐明了多巴胺能神经元特异性的自噬参与吗啡成瘾的分子机制。
毒品成瘾困扰人类健康,是重大社会问题之一,呈慢性复发性依赖病程,表现为强制性用药、敏感化和依赖,其机制至今未明。目前,对于毒品成瘾的治疗缺乏完全有效的方式,强制戒断后复吸率很高。因此,研究成瘾的生物学机制,对于成瘾的治疗与干预具有非常重要的意义。吗啡是阿片类毒品的典型代表,研究吗啡成瘾的作用机制,能为阐明阿片类毒品成瘾的分子机制以及临床治疗提供新的思路和理论依据。
自噬是溶酶体介导的细胞降解自身细胞器和蛋白的过程,与细胞存活、细胞分化、发育和体内稳态密切相关。大量研究表明,自噬异常与很多疾病相关,包括肿瘤、免疫性疾病和神经退行性疾病等。科研人员前期研究显示,吗啡成瘾过程中线粒体功能异常,进而诱发自噬。褪黑素是一种靶向线粒体的抗氧化剂,可以干预这个过程。预先用褪黑素处理细胞和小鼠,能够拯救吗啡诱导的线粒体功能异常,进而拯救吗啡诱导的自噬,最终阻断吗啡诱导的小鼠行为敏感化和光热疼痛耐受(Feng et al. 2013. Autophagy 9: 1395-406)。但自噬是否参与成瘾,抑或是成瘾的副产物并没有阐释。
为了验证自噬在吗啡成瘾中的地位,并阐述吗啡诱导自噬的分子机制,明确自噬在吗啡成瘾和镇痛过程中的作用,昆明动物所姚永刚课题组与合作者从分子、细胞和小鼠动物模型等多个层次开展了系统的研究。首先从小鼠吗啡成瘾模型出发,首先确认吗啡诱导的自噬参与成瘾,而非成瘾副产物。随后,在小鼠原代神经元上集中研究吗啡诱导自噬的分子机制,发现吗啡会导致ATG5和ATG7蛋白表达显著上调,从而促进多巴胺能神经元中ATG12-ATG5复合物形成和Atg5与Atg7依赖的自噬活性增强。进一步研究发现,Atg5与Atg7依赖的自噬通过调控多巴胺能神经元的树突棘密度、树突复杂度和树突总长度,进而调控成瘾行为学。在多巴胺能神经元中特异性敲除Atg5或Atg7基因,能显著拯救吗啡诱导自噬所介导的树突可塑性改变,最终阻断吗啡诱导的成瘾行为学,包括吗啡奖赏效应、行为敏感化、疼痛耐受和戒断症状。该研究结果深入阐述了吗啡诱导自噬产生的分子机制,有望为成瘾的治疗和临床镇痛提供新的思路与科学依据。
昆明动物所博士研究生苏凌燕与罗荣灿为文章的共同第一作者,研究员姚永刚与徐林为共同通讯作者。该工作同时得到同济大学教授丁玉强的帮助。
上述研究得到国家自然科学基金委、中科院脑功能联结图谱先导专项和中科院前沿重点研究项目的资助。
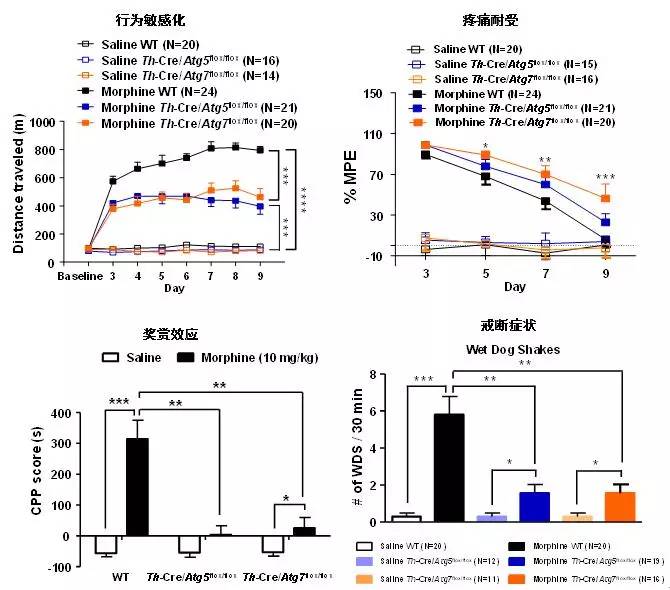
图1. 多巴胺能神经元特异性敲除Atg5或Atg7基因可阻断吗啡成瘾行为
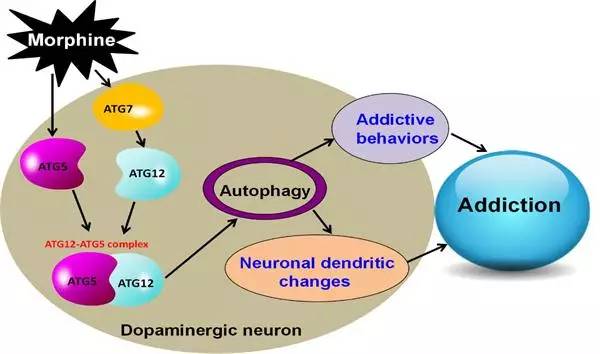
图 2. 吗啡诱导多巴胺能神经元特异性自噬导致成瘾的分子机制
来源:中国科学院昆明动物研究所

 )
)





























我来说两句排行榜