电池在放电的过程中,电路中的电流从正极流向负极。与此同时,欧姆定律明确规定电流由正极流向负极,这便意味着电流与电场强度成正比。不过电池内究竟发生了什么反应?电流是否是从负极流向正极?本篇博客文章将为解释放电和充电过程中电池内部的电势分布情况。
电池中的电流
我记得曾经在物理课上学习过电气系统。欧姆定律告诉我们电流从正电势流向负电势,而电子的移动方向则完全相反;基尔霍夫定律又告诉我们,电流必然具有连续性;即电流不会从系统中“消失”。但是,当研究范围拓展到电池内部结构中的正极、负极和分隔膜中的电解质时,物理老师也很难解释清楚上述两个定律是如何被遵守的——或者学生们无法理解老师的解释。
下方的图 1 展示了上文提到的难题。我们明白的是,放电过程中电流 I 在外部电路中从正极流向负极。那么,电池内的电流是否从负极流向正极呢?电池内部难道不遵守电流连续性吗?答案或许是显而易见的:仅依据欧姆定律是无法解释电池内的情况的。年轻学生们的疑惑可以用所谓的“双电层”来解释清楚。

图 1. 电池内部的电流是否从负极流向正极?
电池内的双电层结构
下面,让我们来看看,如果将金属条浸入电解质(例如盐溶液)中,将会出现什么情况?受金属的类型和结构影响,离子会被吸附在金属和电解质的交界面上。紧挨金属的第一层通常是溶剂分子,不过一些没有溶剂在周围提供保护的离子也可能被接触吸附到了金属表面。请注意,在这种情况下,负离子是被接触吸附到带负电的表面上。由溶剂分子和被接触吸附的离子组成的物质层被表示为内亥姆霍兹平面(inner Helmholtz plane,简称 IHP),请参照图 2。带与金属表面相反电荷的水合离子可能会形成另一个外层,被表示为外亥姆霍兹平面(outer Helmholtz plane,简称 OHP)。
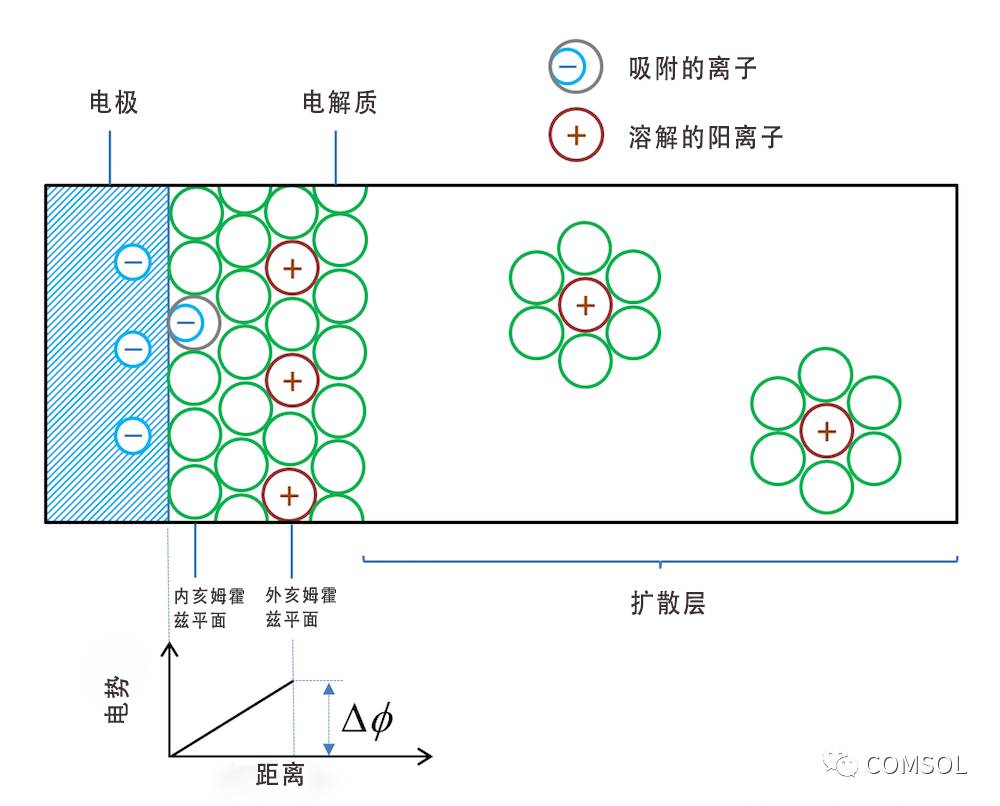
图 2. 双电层的示意图。绿色圆圈表示溶剂分子,双电层右侧实际上充满了溶剂分子,不过我们仅绘制了水合离子周围的溶剂分子。
金属表面和离子层形成了双电层。在描述双电层的电势差 ΔΦ 时,我们没有加入任何净电流。
不同类型的金属对电子的吸附能力存在差距,因此不同的金属会吸引带不同电荷数的离子。这也意味着在没有通电时,浸没在相同电解质中的金属不同,带电双电层的电势也就不同。
如果将由两种金属制成的金属条浸入到相同的电解质中,并使用可避开电流的高阻抗电压表来测量电势,这样就能测量出两电极间的电势差。金属条、带电双电层和电解质的电势分布概况见图 3,图像顶部的圆圈代表着高阻抗电压表。

图 3. 负极、电解质和正极的电势分布情况,它们与可测量开路电压的高阻抗电压表相连。
现在,两个金属条充当了电池电极,其中还原电势较高的金属获得了正电势,还原电势较低的金属获得了负电势。
在图 3 中,电极间的电势差值正好是保持系统电流流动所需的精确临界值。当电池处于断路且平衡的状态时,此时的电池电压被称为开路电压(open cell voltage,简称 OCV),在图 3 中表示为 EOCV。
由锌和铜金属条制成的电池便符合上文的描述。这时,阳极反应是锌溶解,阴极反应是将质子还原成氢。将两个金属条插进一只橙子,就能得到一个简易电池,其中橙汁充当了电解质,可参照链接中的教学模型。
需要注意的是,测量电极的平衡电势基本上是不可能的。这是因为,只要将测量电极插入到电解质中以测量另一个电极的电势,测量电极周围就会产生带电双电层。所以,我们始终通过参照与高阻抗电压表相连的参比电极来测量电极电势。高阻抗保证了测量电极没有任何电流通过,而电流则会改变电极电势。
参比电极的位置如图 4 所示。当静电流为零时,通过对照参比电极测得的电极电势通常被称为平衡电势,在图 4 中表示为 Ee,vs Ref。请注意,在图 4 中,参比电极和高阻抗电压表测量的是负极的平衡电势。

图 4. 浸在电解质中的参比电极表面也形成了双电层,因此对电极电势的测量值产生了影响。
放电过程中的电势
现在,我们可以通过外部电路中的载荷将两个金属条电极连接在一起,请参照图 5。在这里,我们假设集电器(集流体)和馈电器能够使电流均匀地垂直分布在电极中。因此,垂直方向上的电极电势也是均匀的,只有沿电池厚度方向(以负极为起点)上的电势会发生变化。
将两端电极连接在载荷上后,负极的电势随之增加,双电层的电势差进而减小。较高的电势会强行将金属阳离子排出到电解质中,并在阳极反应中将电子释放到外部电路。在我们的小电池中,阳极反应可以表示为:
正极的电势较低,因此吸引了更多带正电的离子,这些离子能够接收在阴极反应中被排出的电子。此外,在这种情况下,双电层中的总电势差将减小。在我们的电池中,贵金属的阴极反应可能是析氢,反应的第一步也许涉及到了形成吸附的氢原子:
图 5 清晰地绘制了开路和放电过程之间的电势变化,以及为什么放电过程中电池电压会降低。

图 5. 放电过程中电池的电势。请注意,由于欧姆降,金属条(蓝线和红线区域)的电势存在一个斜坡。
由于没有电流通过,即使在放电过程中,参比电极的电势依旧取决于溶液;也就是说,参比电极没有被极化。由此一来,参比电极便可以用来分别测量两个金属条电极的极化。在测量时,我们将同时获得沿金属条厚度的欧姆损耗。如果将参比电极置于中间,这些损耗情况可以通过蓝线和红线区域内的缓斜率显示出来,其中一半欧姆损耗将发生在电解质中。
图 5 显示了金属中的电流和位于除双电层外之外的电解质中电流所引起的纯电阻,在许多电池电解质中,扩散作用也可能有所贡献。在双电层之外的电解质区域内,电流确实从正电势流向负电势。
区域内,其精度达到了纳米级,而对比之下,电极和电解质的厚度通常为毫米级。因此,在数值建模中,双电层被视为不连续体。我们用一个因变量来描述电解质的电势,该变量通常表示为 Φl,然后用另一个因变量来描述金属电极的电势,其通常表示为 Φs。由此,双电层电势差的定义为 ΔΦ = Φs – Φl。
电荷转移反应、电荷转移电流和超电势
双电层中无电流通过时的电势和有电流通过时的电势之差被称为过电位。像之前一样,由于我们只能对照参比电极来测量带电双电层,因此测量超电势 η 时也需要对照参比电极。
过电位能够改变电荷转移反应(即阳极氧化反应和阴极还原反应)的活化能。图 6 绘制了金属 Me 被阳极氧化为 Me+ 的过程。活化能例图中的 x 轴是负极氧化还原反应的反应坐标。此绘图描述了自由能和双电层电势差 ΔΦ 之间的关系。

图 6. 电荷转移反应的活化能随双电层电势差的变化而变化,从而加快或减慢电荷转移反应。
我们可以通过增加负极的电势来加快阳极氧化反应的速率,从而略微减小双电层的(负)电势差。在上图中,电势改变了带电物质的自由能。因此,电荷转移反应从充当了阳极的金属条中“拿走”了电子,并将金属离子输送到电解质中。电子通过外部电路,流经载荷到达正极,如图 5 所示。图 5 还显示了电解质中的离子在电场中迁移的同时,将电解质中的电流传递了到正极。
图 5 和图 6 中的反应过程也可以表示在电荷转移电流密度 ict 与电势的函数关系图中,如图 7 所示,其中电荷转移电流密度可用于计算电荷转移反应中转移的电子数量。两条曲线显示了电解质和金属交界面上的电荷转移电流密度与电势的函数关系。蓝色和红色曲线分别表示负极和正极。
在放电过程中,当阳极超电势为 ηa 时,负极的阳极电流密度值为 ict,a;也就是说,电极被正极化,这同样符合上方的图 5。电势差 ΔΦ 是一个较小的负值,而平衡状态下的电势差变成了一个较大的负值,从而使超电势为正。阳极电流,顾名思义为正电流。
正极被负极化,根据其定义,即正极释放出带负电的阴极电流。在这种情况下,如果金属条的面积相等(Kirchhoff 数),那么电流的值 ict,c 与阳极电流密度的绝对值相等,但是符号相反。对应的阴极超电势为 ηc。如果不存在质量传递限制,那么 Butler-Volmer 方程可以描述图 7 中的红色和蓝色曲线。
与图 5 一样,图 7 还解释了为什么与图 3 中的开路电压相比,放电过程中的电池电压 Ecell 降低了。实际上,电池电压的下降程度或许比图 7 中更多,这是因为一部分电势也在欧姆损耗中损失了,只不过它们没有被包含在绘图中。

图 7. 在放电过程中,电荷转移电流密度分别与金属条电池中负极电势和正极电势之间的函数关系。在这种情况下,放电电流密度为 abs(ict,c) = ict,a。
为电池充电
现在,假设我们要为金属条电池充电。在充电过程,电荷转移反应须逆向进行,使负极发生阴极电荷转移反应,正极发生阳极电荷转移反应。
图 8 显示了为了实现再充电,负极必须增强自身的活性,而这将增加带电双电层的电势。这一过程与图 6 中的净还原反应相对应。现在,负极变成了带负电荷转移电流密度的阴极。阴极还原反应如下:
正极必须增加自身的活性,这也会增加带电双电层的电势。这一过程对应的是电池的净氧化反应。现在正极变成了阳极,带正电荷转移电流密度。在含水电解质中,对于更“昂贵”的金属条而言,通常发生的是氢氧离子的氧化反应。氧化反应的第一步或许涉及了氢氧基的吸附:
第二步将生成水和氧气。为了将金属离子释放到溶液中,金属的还原电势越高,所需的电势也就越高。因此,通常情况下,水电解质中的反应首先是氧化氢氧离子,或者分解水并产生氧气。
图 8 解释了为什么电池充电所需的电压比开路电压更高。
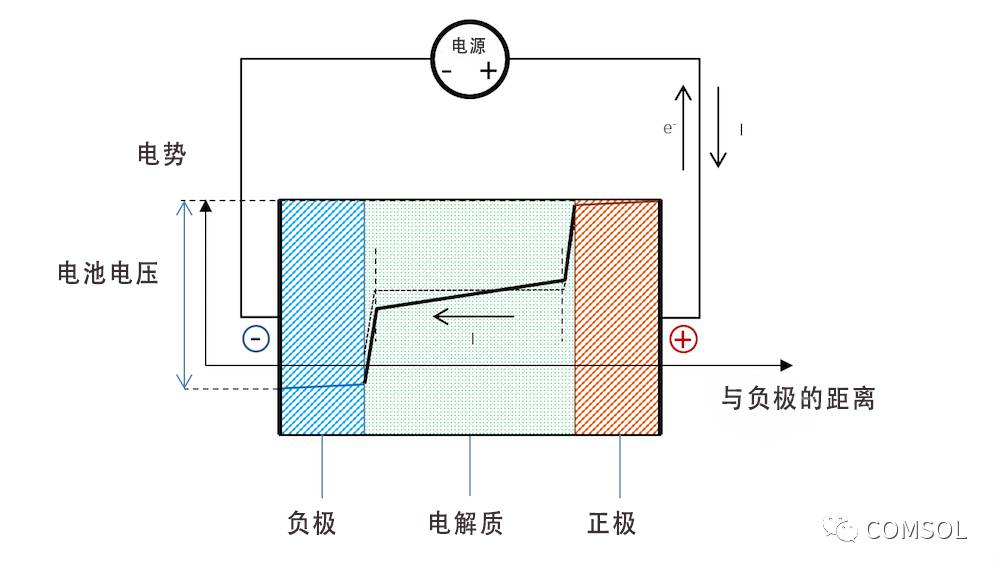
图 8. 充电过程中电池的电势。请注意,充电过程与放电过程一样,由于电阻降,两个金属条(蓝线和红线区域)的电势存在一个斜率。
图 9 显示了由发生在两个金属电极表面的电荷转移反应引起的电流密度。负极被正极化,释放出阴极电流,根据其定义,阴极电流带负电。正极的活性增强;即正极极化,获得阳极电流。下方绘图也解释了为了驱动所需的阳极和阴极电流,为什么再充电过程中电池电压必须高于开路电池电压。
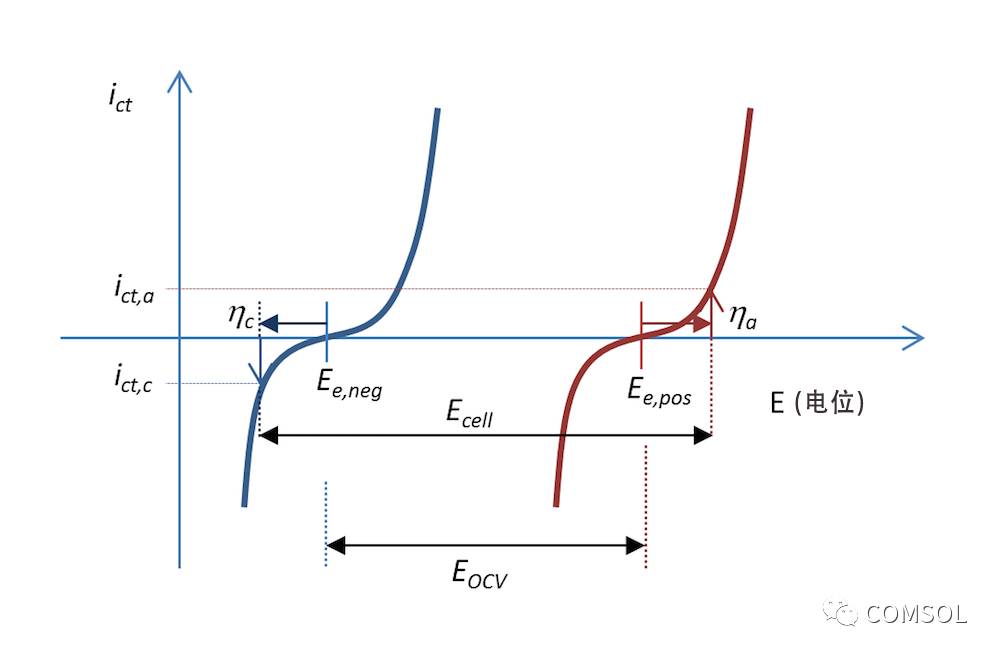
图 9. 在充电过程中,当电流密度为 ict 时,电荷转移电流密度与金属条电池中负极电势和正极电势的函数关系。
多孔电极
在现实中,大多数电池使用的是多孔电极,而非将固体金属条用作电极。电化学反应获得了更大的表面积,结果是电池单元的电能输出不变,但变得更加轻巧“紧凑”。在这些电池中,电极的小孔中含有电解质,可表示为孔隙电解质。孔壁与孔隙电解质相接触,周围形成了许多带电双电层,不仅增加了表面积,还减少了局部电荷转移电流密度以及放电和再充电过程中的超电势损耗。
图 10 显示了带多孔电极的电池在开路电压下的电势分布。我们对自由电解质和孔隙电解质中的电解质电势均进行了定义。

图 10. 在带多孔电极的电池内,电解质、孔隙电解质和多孔金属中的电势分布。
当电池放电时,电流从电极材料流向负极的孔隙电解质。这意味着,从负极多孔电极的馈电器,到面向电解质的边缘处,即沿 x 轴从左向右,孔隙电解质中的纯欧姆电流密度呈现出增长趋势,如图 11 所示。
由于平均电流密度随 x 的增加而变化,并非一个恒定常数,因此孔隙电解质中电势分布的曲线斜率同样不是常数。电势分布曲线如图 11 所示。在负极的孔隙电解质中,电解质电势(绿色曲线)的斜率随 x 增加而增大。多孔金属的电势斜率(蓝色曲线)随 x 增加而减小,这是因为在电荷转移反应中电流沿 x 轴转移到了电解质中。
在正极中,化学反应逆向进行。在面向自由电解质的边缘处,孔隙电解质的电势(绿色)达到最大,之后随 x 的增加而减小,这是因为电流从正极的孔隙电解质转移到了多孔金属中。随着越来越多的电流从孔电解质中转移出来,多孔金属(红色区域)中的电势斜率随 x 的增加而增加。在集流体处,所有电流流入到金属中。

图 11.使用了多孔电极的电池在放电过程中的电势分布。
关于电池内电流的总结
虽然本篇博客讨论的主题并不是人们关注的领域,但是如果想要清楚地理解电化学的概念,上述原理是必不可少的内容。不仅如此,我们还需要阅读一些专业资料,并且动手完成建模和仿真工作。难怪我的中学老师很难在学校里解释清楚这个概念!
扩展阅读
橙子电池教学模型
一维等温锂离子电池教学模型
J. O’M. Bockris and A. K. N. Reddy, Modern Electrochemistry Volume 2, Springer-Verlag, 1970.
J. Newman and K. E. Thomas-Alyea, Electrochemical Systems 3rd Edition, Wiley, 2004.
 )
)





























我来说两句排行榜