作者:Elisa Corsiero (e dot corsiero at qmul dot ac dot uk)
Queen Mary University of London, London, England
译者:潘海建 上海交通大学农业与生物学院食品科学与工程系
简介
抗体结构
免疫球蛋白(Ig)或抗体是免疫系统的重要组成部分,根据结构它们扮演了双重角色。它们1)能够通过抗原结合片段位点特异性结合抗原,2)通过Fc段激活免疫系统其他细胞介导免疫反应(图一)。它们可分为多克隆抗体-多种抗体能识别抗原多个表位和单克隆抗体(mAbs)。后者是高度特异性的抗体,只能识别抗原的某一特定表位,它们在40年前被首次发现。在过去的这些年里,单抗已经成为基础研究的无价之宝,被广泛应用于免疫组化、流式细胞、免疫印迹及相关技术中 [1] 。 除此以外,在最近的20年里,单抗也成为癌症治疗的重要组成部分。它们的医疗应用可以扩展到慢性炎症疾病、移植和感染中 (例如HIV单抗在治疗人类HIV疾病中效果显著)。到目前为止,已有约30中单抗被FDA授权用于以上疾病的治疗 [2] 。因此,人们对这种类型抗体的兴趣逐年增长,该领域的研究也日益增加。
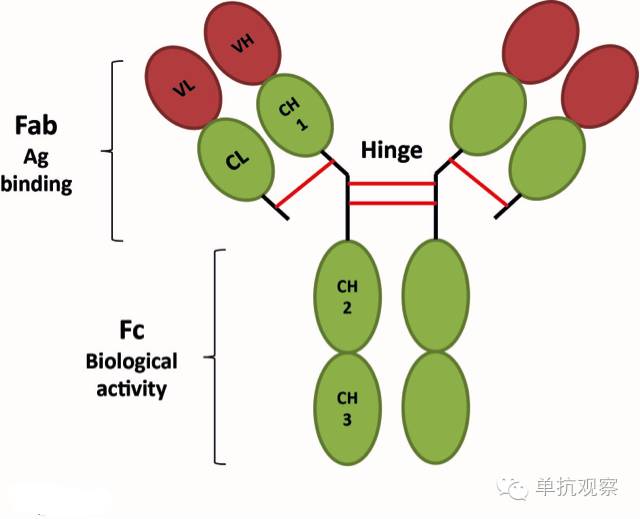
图 1. 免疫球蛋白IgG结构。 IgG分子的简化表示显示了两个抗原结合位点(Fabs段)和功能域(Fc段)。
人类的抗体分子包含两个相同的重链和两个相同的轻链,通过二硫键共价连接。每条链包含一个可变区(VH和VL)用于抗原识别,和一个恒定区发挥效应功能(CH1-3和CL)(图一). 重链也包含一个铰链区。基于Fc部分,抗体可被划分为五种:IgG, IgM, IgD, IgA,和IgE。重链和轻链都在氨基端有一个由110个氨基酸组成的可变区,它包含三个被称为互补决定域(CDR1, CDR2和CDR3)的高变区,它们植入于四个保守的骨架区(FRs)。CDR3通常是最多变的区域,作为抗原结合位点的中心。
制造人源单抗的步骤
人源单抗可通过杂交瘤细胞,展示技术如噬菌体展示,和单分拣的人B细胞。还有几个更复杂的技术在本文中不展开论述,包括 [3] :
将小鼠杂交瘤细胞的CDR区移植到人源的轻链可变区和重链骨架区;
利用表达人源Ig基因的转基因小鼠(基于传统的杂交瘤方法)表达人源单抗。
杂交瘤技术

杂交瘤技术是一种古老的方法,常被用于制备单抗。目前许多实验室仍在用该方法。该方法将产生抗体的B细胞与骨髓瘤细胞系融合(杂交),然后在选择培养基培养,只有生产特定单抗的融合细胞能够在选择培养基中存活。
它是如何工作的?
B细胞从被特定抗原免疫的小鼠脾脏中分离出来,B细胞能针对该抗原生成特定单抗,通过富集获得抗原特异性的B细胞种群。将这些B细胞与筛选的骨髓瘤B细胞系融合(即通过化学物质或者病毒介导进行融合),该骨髓瘤细胞缺少编码次黄嘌呤-鸟嘌呤-磷酸核糖转移酶(HGPRT)的基因,且自身不能产生抗体。这一选择过程是重要的,这两种类型的B细胞被接入含有次黄嘌呤-甲氨喋呤-胸腺嘧啶核苷的选择培养基(HAT培养基)中培养,只有杂交瘤细胞能够存活,因为骨髓瘤细胞在该培养基中无法分裂,而能产生特定抗体的B细胞在分裂几代后就死亡率。因此只有杂交瘤细胞能够分裂和复制。经过筛选能够产生目的单抗的杂交瘤克隆,这些单抗就能够从培养上清中分离出来。尽管该方法仍然是单抗制备的“金标准”,它有一些缺陷,即无限增殖和融合的效率通过很低,或者B细胞的成熟状态也很重要 [4] 。为了克服这一缺陷,在2003年Michel Nussenzweig实验室开发出来高效克隆和表达单抗的方法,从流式细胞分离单个B细胞开始(详见下面的段落)。
单细胞筛选技术

制备人源单抗的有效方法是基于流式细胞仪的B细胞单细胞分拣,Ig基因(包含重链和轻链基因)的PCR扩增,以及随后的体外抗体表达载体克隆。
它如何工作?
生产人单抗的单个B细胞分拣的策略是基于从单个细胞cDNA进行人IgH,Igκ和Igλ的PCR扩增。用特定的正义链和反义链引物PCR分别扩增得到重链和轻链(κ和λ)。扩增后将PCR产物克隆到特定表达载体中表达重链和轻链。该载体随后被转染进人的细胞系中来表达人源单抗,通过培养基上清分离得到抗体。详细步骤可参考这篇文章 [4] 。
噬菌体展示文库

噬菌体展示于30年前出现,它最早是由MRC分子生物学实验室的Greg Winter等人和Scripps研究机构的Richard Lerner, Carlos Barbas等人分别开发出来的。噬菌体展示文库制备的单抗可以是Fabs、scFvs (单链可变片段)或sdAbs (单域抗体) (图1和2a)。 抗体序列通常与基因III衣壳蛋白融合 [5-7] 。
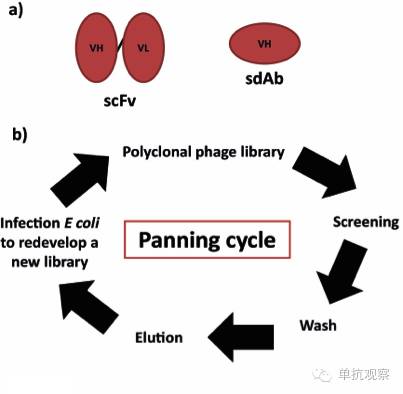
图 2. (a) scFv 结构(左) 包含两个结构域,一个重链可变区(VH)和一个轻链可变区(VL)通过一个柔性接头连接; sdAb (右)结构包含一个单一结构域,通常是重链可变区。 (b) 噬菌体展示的一般步骤。
它如何工作?
所有抗体噬菌体展示文库的原则都是基于将抗体的特异性和亲和性(表型)与噬菌体颗粒序列(基因型)进行的物理连接。随后是快速抗原特异性抗体的体外筛选。如图2b总结,将表面的多克隆噬菌体表达重组抗体与固定在磁珠、聚苯乙烯表面,或细胞表面的靶抗原进行结合。经过几轮对非结合的噬菌体严格洗脱后,抗原结合的噬菌体通过pH值改变或蛋白酶消化被洗脱下来。筛选出来的噬菌体被用于感染大肠杆菌,来制备新的文库用于下一轮的筛选。不断重复这一“全循环”直到富集得到单克隆的噬菌体。抗体序列被复原,被用于表达重组抗体 [6] 。
日常使用的抗体序列和结构数据资源
抗体序列的主要资源是The ImmunoGenetics Database (IMGT) (https://www.imgt.org/)。 IMGT是免疫球蛋白的全球资源,它被定期更新,包含抗体的所有种系基因序列。第二大有用的抗体序列网站是IgBLAST (https://www.ncbi.nlm.nih.gov/igblast/),它由NCBI开发特异性的包含免疫球蛋白的可变区序列。对于抗体结构数据库,有一些好用的资源:Protein Data Bank (PDB) (https://www.rcsb.org/pdb/home/home.do), CATH数据库网站(https://www.cathdb.info), 抗体晶体结构(SACS), IMGT-3D结构-DB。有几个好用的工具可用于抗体序列研究。它们中,抗体模型构建Rosetta Online Server (https://rosie.rosettacommons.org)是3D结构预测的开放网站。糖基化预测,NetNGlyc1.0 Server (https://www.cbs.dtu.dk/services/NetNGlyc)被用于预测人源抗体N-糖基化位点的存在;NetOGlyc4.0 (https://www.cbs.dtu.dk/services/NetOGlyc) 可用于O-glycosylation糖基化位点的预测。
单抗的体外表达

HEK293或CHO细胞系
抗体生产的最后步骤是它们在宿主系统中的表达。选择哪种细胞系进行转染是很关键的,在开始表达项目前需要评估一下。的确,后来改变表达系统能够影响您要制备的抗体活性。选择宿主系统的重要性主要取决于蛋白质的翻译后修饰。特别是,对于抗体来说糖基化是最常见的翻译后修饰,能够影响蛋白折叠、稳定性、溶解度、蛋白活性和免疫原性等 [8] 。表达系统包含细菌、酵母、动物细胞、昆虫、植物以及体外表达系统。通常,哺乳动物细胞被用于单抗制备,因为它们能正确组装并引入翻译后修饰(Handbook of Therapeutic Antibodies 2E (2014))。 有几种哺乳动物细胞可作为宿主系统,然而每种系统的糖基化类型有所不同。通常,在研究实验室中能成功用于表达抗体的为中国仓鼠卵巢细胞(CHO)或人胚胎肾细胞(HEK293). 然而,CHO系统的瞬时转染效率低,产生的蛋白产量也不高。因此HEK293作为瞬时转染的主要细胞系。除了您该选择哪种细胞系以为,还需要时刻记住制备抗体的糖基化类型与体内真正循环的有所不同。下表总结了可用于瞬时转染的HEK细胞系类型:
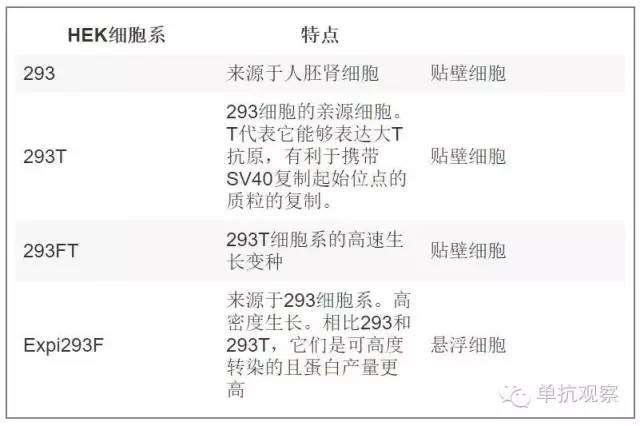
表一: 瞬时转染的HEK细胞系。
转染试剂
商品化的转染试剂试剂盒很多。因此根据您的实验挑选最好的是很重要的。要问的第一个问题是你希望获得的蛋白产量,这取决于你用该抗体进行的实验的类型和次数。最常用最便宜的是聚乙烯亚胺(PEI)。PEI是一种阳离子聚合物,能够将DNA聚合成阳离子颗粒通过内吞作用进入细胞。一旦进入细胞,囊泡能够将DNA聚合物释放到细胞质中。复合物解体后DNA就能够扩散到细胞核中。PEI介导的转染主要局限在于能够获得的蛋白产量太低,通常在微克级别。不过对于初次筛选抗体库已经足够了。如今市场上出现了几种能提高蛋白产量的转染试剂。虽然价钱更贵但它们的效率更高,这可以让您免于多次制备同一种抗体,每次都能省掉一些其他步骤(即纯化、质量控制等)。Thermo Fischer Scientific网站上列出了主要的转染试剂(https://www.thermofisher.com)。总结如下表:
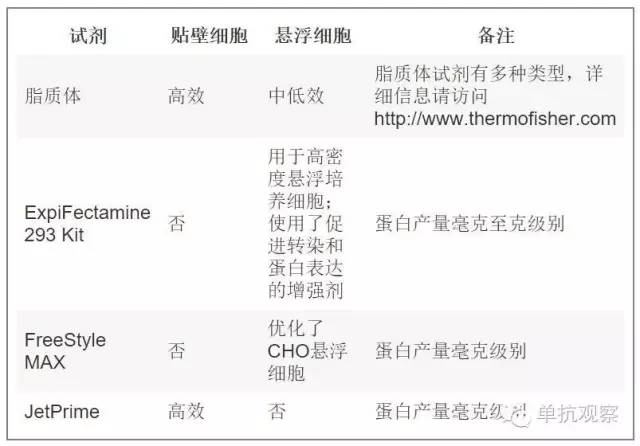
表二:抗体制备的常用转染试剂。
表达质粒
表达质粒也是表达系统的重要组成部分,如今也完善起来。表达质粒的优化在于强启动子和增强子的鉴定和优化,来获得更高的转录和翻译水平。确切来说,需要用到一些特定的启动子/增强子,如巨细胞病毒(CMV),SV40, 延长因子启动子, 多瘤病毒增强子, 鸡beta-肌动蛋白启动子。对于抗体制备来说,瞬时转染通常用到两套载体,一套用来编码重链一套编码轻链。然而,共转染有一些缺陷,例如需要大量的载体,这会增加成本,也费时费力。有一些研究通过利用同时表达重链和轻链的载体(一步法组装)来解决这一问题 [9] 。
新形态抗体:非常规抗体
大多数用于治疗的抗体为人源化抗体或嵌合单抗。这些单抗已经被验证非常成功,但如今出现了一些非常规抗体,来提高组织渗透药物代谢和药理功效。 新形态的抗体包含Fab片段(轻链和重链的CH1区通过二硫键链接), FV片段(V区),单链抗体-scFvs (用柔性肽段连接V区)。还有一些其他形态的抗体片段。如两种不同特异性的抗体片段可连接起来形成双特异性抗体或双抗体。对非常规抗体的新形态的深入描述和它们应用介绍的文章可在这里查看 https://dx.doi.org/10.13070/mm.en.3.160 。
实验室水平上通过亲和层析进行抗体纯化的方法

通常制备的抗体为IgG亚型的。因此对它们的纯化方法是基于蛋白A或G的亲和层析方法。人源抗体总结表格如下:
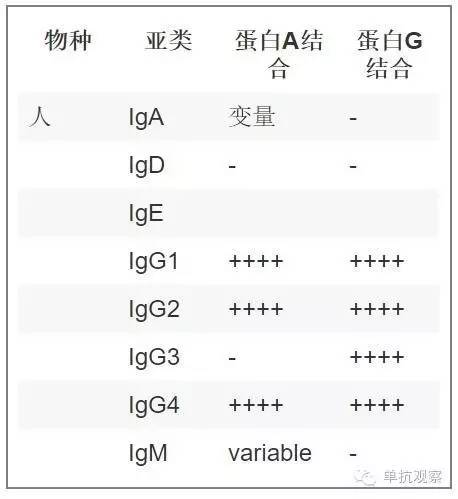
表三: 抗体亚类及相应蛋白A/G结合水平。修改自Affinity Chromatography Handbook (GE Healthcare网站)
通过亲和层析纯化抗体是基于抗体的Fc段与固定在层析介质上的特定配体(即蛋白A/G)的可逆反应实现的。蛋白A和G均来自于细菌,分别来自金黄色葡萄球菌和链球菌。在于配体结合后(结合阶段),可通过改变洗脱阶段的pH值逆转反应。亲和层析技术是一种能从大规模培养物(如培养上清)中一步法高效回收抗体的方法。GE Healthcare网站的抗体回收说明书很有用,它包含了样品准备和抗体纯化的最常用步骤,可以作为您准备进行抗体纯化的参考书(www.gelifesciences.com/Handbooks/Antibody_purification_handbook)。
小规模纯化
抗体小规模纯化在抗体筛选中很有用。它可通过以下步骤实现: i) 用能够用蛋白A或G包被的层析柱或预包被的层析柱 (即一次性聚丙烯柱); ii) 蛋白A或G包被的96孔板用于高通量筛选。在第二套系统中,抗体可上样到孔中,冲洗和洗脱可通过离心或利用真空系统实现。
大规模纯化–ÄKTA系统
通常在实验室水平而非用于工业用途也需要制备不同量的抗体,从微克级别到克级别都用。因此利用自动纯化系统来增加产量和纯度就非常重要了。在市场上,有几个自动纯化系统大多利用了GE Healthcare的ÄKTA层析机器。在手动纯化(如上小规模纯化)变得费时的时候使用这些系统通常能得到重复性更好的结果。手动纯化变得费时的原因包括: i)需要获得更多抗体, ii) 样品的初始量太大, iii)需要纯化许多样品。自动层析系统价钱偏贵,但投资这些系统会使有一些应用变得省时省力,节省样品,最重要的是能提高产量。GE Healthcare有几种ÄKTA的机器。主要的如下列出:
ÄKTA start
ÄKTA prime plus
ÄKTA xpress
ÄKTA pure
ÄKTA avant
ÄKTA pilot
ÄKTA ready
ÄKTA process
从1到5的ÄKTA用于实验室级别。从6到8的用于工业生产级别。更多细节请查阅: www.gelifesciences.com/Handbooks/Antibody_purification_handbook。
表面等离子体共振:Biacore
Biacore系统(图3a)利用表面等离子体共振(SPR)原理实时监测分子间相互作用。该分析包含两个相互作用的分子,一个结合在传感器(配体),另一个在将通过配体的溶液(分析物)中。抗体可以是配体也可以是分析物。在配体与分析物结合后,传感器表面可生成与结合量等比例的反应,来确定兆摩尔或纳摩尔级别的浓度。Biacore系统在研究抗体中非常有用,因为它能反映:
抗体与抗原相互作用的特异性;
抗体与抗原相互作用的动力学和亲和力;
特定分子的浓度。
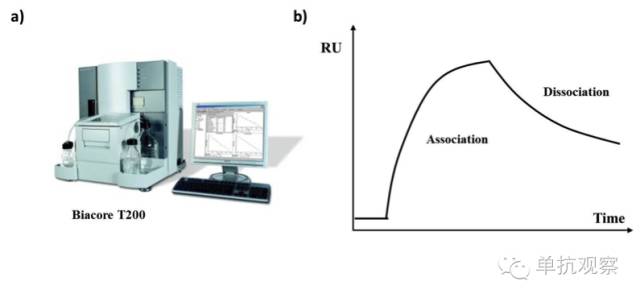
图 3. (a)生物传感器例子(b)感应图示意图;RU = 共振单元
共振单元(RU)可反映共振信号的改变,通常与时间相对应,以感应图的形式呈现(图3b)。
总结: 制备工业水平的抗体

如今,单抗制备已经不仅仅局限于实验室中,有一些医用用途的抗体也被制备出来了。因此,应用于标准实验室的标准步骤主要用于抗体筛选而不是医疗用途。确实,大规模制备用于人的抗体需要更加精确的策略和控制步骤,这些都需要标准化以制定高滴度抗体生产的平台。确切来说,它包含了i)构建稳定转染而不是瞬时转染,ii)用生物反应器培养细胞,iii)从分泌产物中去除细胞,以及利用多种层析和过滤技术从细胞培养上清中纯化抗体,iv)改变缓冲液,将抗体重悬于希望的配方以满足临床用途。所有这些步骤都余姚不断的质量控制测试来确保安全和生物活性。因此所有这些步骤都只能在工业水平而不是标准实验室水平实现。
参考文献

Weiner G. Building better monoclonal antibody-based therapeutics. Nat Rev Cancer. 2015;15:361-70
Li J, Zhu Z. Research and development of next generation of antibody-based therapeutics. Acta Pharmacol Sin. 2010;31:1198-207
Voula Kodoyianni MH, Marjorie Curet, Rachel Kravitz, Brian Schram A Novel Process for Developing Fully Human Monoclonal Antibodies. 2012.
Wardemann H, Kofer J. Expression cloning of human B cell immunoglobulins. Methods Mol Biol. 2013;971:93-111
Arbabi-Ghahroudi M, MacKenzie R, Tanha J. Selection of non-aggregating VH binders from synthetic VH phage-display libraries. Methods Mol Biol. 2009;525:187-216, xiii
Chan C, Lim A, Macary P, Hanson B. The role of phage display in therapeutic antibody discovery. Int Immunol. 2014;26:649-57
Hoogenboom H. Selecting and screening recombinant antibody libraries. Nat Biotechnol. 2005;23:1105-16
Krista Steger PD, James Brady, Ph.D., Meg Duskin, Karen Donato, Ph.D. Literature Review: CHO versus HEK Cell Glycosylation. wwwmaxcytecom.
Dodev T, Karagiannis P, Gilbert A, Josephs D, Bowen H, James L, et al. A tool kit for rapid cloning and expression of recombinant antibodies. Sci Rep. 2014;4:5885
Doerner A, Rhiel L, Zielonka S, Kolmar H. Therapeutic antibody engineering by high efficiency cell screening. FEBS Lett. 2014;588:278-87
本文由单抗观察整理于来邦网
 )
)






























我来说两句排行榜